-
碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═ H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
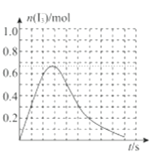
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
-
碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═ H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
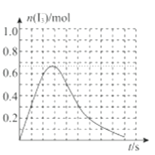
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
-
碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________(用△H1、△H2表示)。
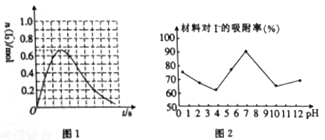
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)  I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
-
AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
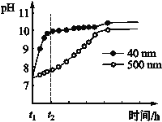
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
-
(17分)铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:
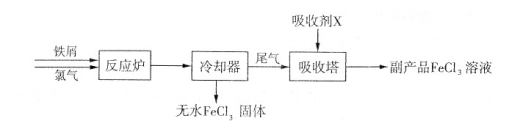
①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):
(已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O===Cd2(OH)2CO3 +A。则A的化学式为 。
+A。则A的化学式为 。
-
铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:

①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d、铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明): (已知:25℃时,溶度积常数Ksp(FeS)=6.310-18、Ksp(CdS)=3.610-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O=Cd2(OH)2CO3 +A。则A的化学式为 。
+A。则A的化学式为 。
-
明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:
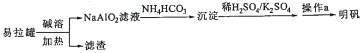
下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
-
明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:
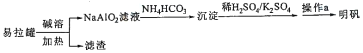
下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
-
铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。由此产生的 等废气处理意义重大。
等废气处理意义重大。
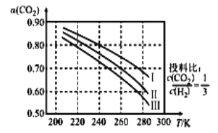
(1)将 应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为
应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为 。如图为
。如图为 平衡转化率和温度、压强的关系,其中压强分别为
平衡转化率和温度、压强的关系,其中压强分别为 。据图可知,该反应为_______反应(填“吸热”或“放热”)。设
。据图可知,该反应为_______反应(填“吸热”或“放热”)。设 的初始浓度为
的初始浓度为 ,根据
,根据 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数 _________(列式即可)。若4.0Mpa时减小投料比
_________(列式即可)。若4.0Mpa时减小投料比 ,则
,则 的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
(2) 时,向某恒温密闭容器中加入一定量的
时,向某恒温密闭容器中加入一定量的 和
和 ,发生反应
,发生反应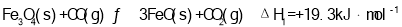 ,反应达到平衡后,在
,反应达到平衡后,在 时刻,改变某条件,
时刻,改变某条件, 随时间(t)的变化关系如图1所示,则
随时间(t)的变化关系如图1所示,则 时刻改变的条件可能是______(填写字母)。
时刻改变的条件可能是______(填写字母)。
a 保持温度不变,压缩容器 b 保持体积不变,升高温度
c 保持体积不变,加少量碳粉 d 保持体积不变,增大 浓度
浓度
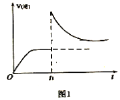
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应 ,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②T℃时,若向平衡体系中再充入
,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②T℃时,若向平衡体系中再充入 的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
(4)已知25℃时, ,此温度下若在实验室中配制100mL 5 mol∙L−1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 mol∙L−1的盐酸___________mL(忽略加入盐酸体积)。
,此温度下若在实验室中配制100mL 5 mol∙L−1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 mol∙L−1的盐酸___________mL(忽略加入盐酸体积)。
-
铁及其化合物在生活中有广泛应用。
(1)Fe3+基态核外电子排布式为______。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为______。
②类卤素离子 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 ,这两种酸中沸点较高的是______
,这两种酸中沸点较高的是______
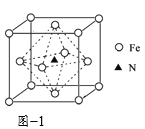
(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为______。
(4)某铁的化合物结构简式如图−2所示
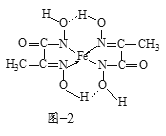
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
H2(g)+
I2(aq)△H2









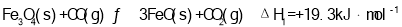 ,反应达到平衡后,在
,反应达到平衡后,在


