-
下列化学药品的保存方法合理的是
A. 金属钾保存在乙醇中 B. 常温下浓硫酸可存放在铁质容器中
C. NaOH溶液保存在玻璃塞的试剂瓶中 D. FeCl3溶液中加入少量还原铁粉存放
难度: 简单查看答案及解析
-
下列化学用语或物质结构的表述正确的是
A. 中子数为10 的氧原子:
B. 过氧化氢的电子式:H—O—O—H
C. CS2中各原子最外层都满足8 电子结构
D. CH2Cl2是四面体构型的含非极性键的分子
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/nm
0.160
0.143
0.070
0.066
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A. 元素的金属性:X
B. 原子Z的价电子数为5
C. 元素的简单离子半径:r(X2+)>r(W2-)
D. 元素Y的最高价氧化物对应的水化物能溶于氨水
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。下列有关说法不正确的是
① 太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g) △H1= +571.6kJ/mol
② 焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)= CO(g)+3H2(g) △H3=+206.1kJ/mol
A. 由反应① 知H2的燃烧热为571.6kJ/mol
B. 反应② 中生成物的总能量高于反应物的总能量
C. 反应③ 若改用新催化剂,△H3不变化
D. 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ/mol
难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是

A. m点处反应:H++OH-=H2O
B. p点:c(NH4+)>c(OH-)>c(H+)
C. 若取原溶液做焰色反应实验,焰色应为黄色
D. 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+)
难度: 困难查看答案及解析
-
一定条件下,CO2(g)+3H2(g)
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
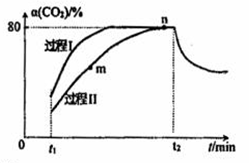
A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
难度: 困难查看答案及解析
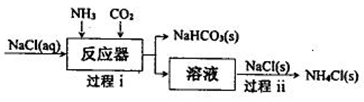
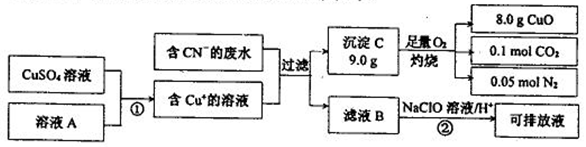
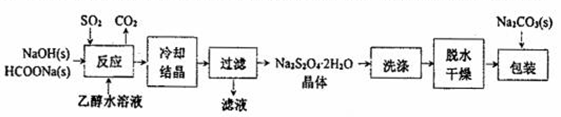
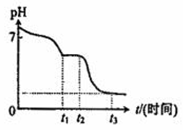
 ______
______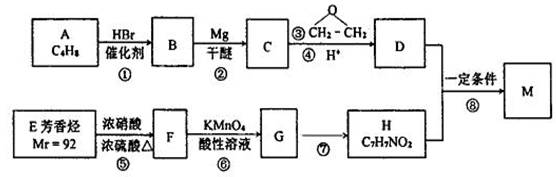
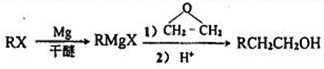
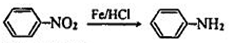 (苯环上的—NH2易被氧化)。
(苯环上的—NH2易被氧化)。
