-
含硫化合物在生产、生活中有较广泛的应用。请按要求回答下列问题。
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。它的制备工艺流程如下图所示,请按要求回答下列问题。
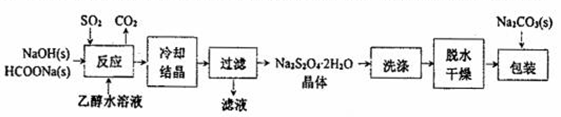
(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:__________。
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是__________。
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如右图所示:(忽略溶液体积的变化)。
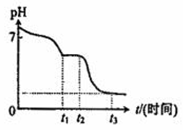
① t1~t2段溶液中S元素的化合价为____________。
② t3时刻后溶液的pH为__________。
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)  2SO3(g),推测此反应的△S(填“>”或“<”) ______0,△H(填“>”或“<”)______0。
2SO3(g),推测此反应的△S(填“>”或“<”) ______0,△H(填“>”或“<”)______0。
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)] 随时间(t)的变化曲线图:
 ______
______
(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
则三容器中反应分别平衡时K的大小关系是_____________;
SO2的平衡转化率的大小关系是____________________。
-
连二亚硫酸钠(Na2S2O4)又称为保险粉,常作还原剂,能溶于冷水,难溶于乙醇,在碱性介质中稳定。
Ⅰ.用甲酸钠(HCOONa)生产保险粉的工艺流程如图:
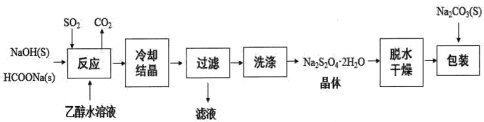
回答下列问题:
(1)Na2S2O4中硫元素的化合价为_____________。
(2)“滤液”中可以循环利用的物质是__________。
(3)“洗涤”所用试剂最好为_________ (填序号)。
a.冰水 b.热水 c.无水乙醇 d.90%乙醇水溶液
(4)“反应”在70℃条件下进行,写出发生反应的化学方程式_______。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_______。
Ⅱ.探究保险粉的性质
(6)现将0.05mol·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:
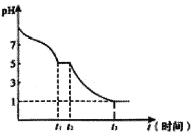
①t1时溶液中含硫元素的粒子浓度由大到小的顺序___________________。
②t2→t3段发生反应的离子方程式为_______________。
(7)取少量连二亚硫酸钠在隔绝空气的条件下加强热使其完全分解,得到Na2SO3、Na2S2O3和一种气体(STP),该反应中氧化产物、还原产物的物质的量之比为__________________。
-
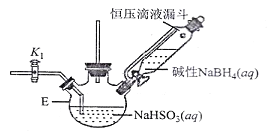
保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
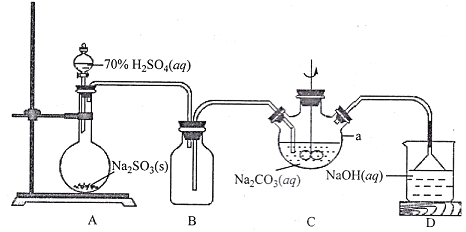
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。

(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
-
保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备

(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
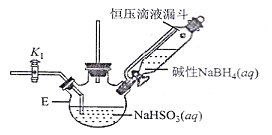
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
-
保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
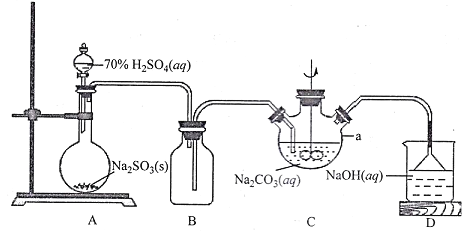
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
-
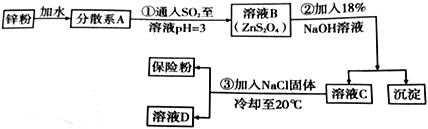
广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:
请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
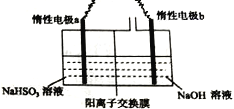
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 mol•L-1Na2S2O4溶液在空气中的pH变化如下图所示;
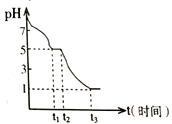
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ mol•L-1(填具体数值,不考虑溶液体积变化)
-
Na2S2O4·2H2O是染料工业中常用的还原剂,俗称保险粉。它可溶于氢氧化钠溶液并稳定存在,难溶于乙醇,受热易分解,制备保险粉的流程如下:
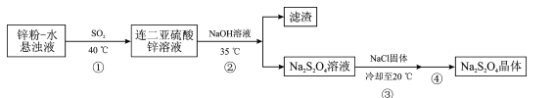
回答下列问题:
(1)保险粉的制备过程要在无氧条件下进行,原因是__________
(2)若用Na2SO3固体和酸反应制备SO2气体,下列最适宜选用的酸是____(填标号)。
A.浓盐酸 B.稀硝酸 C.70%硫酸 D.98%硫酸
(3)步骤②需要控制温度在35℃的原因是__________已知pH>11时,Zn(OH) 2转化为 ,为了使Zn2+沉淀完全,则加入氢氧化钠溶液调节溶液的pH范围是______________(25℃时Ksp[Zn(OH)2]=1.0×10‑17,35℃时Ksp与Kw的变化可忽略)。
,为了使Zn2+沉淀完全,则加入氢氧化钠溶液调节溶液的pH范围是______________(25℃时Ksp[Zn(OH)2]=1.0×10‑17,35℃时Ksp与Kw的变化可忽略)。
(4)步骤③中加入一定量NaCl固体的目的是____。
(5)步骤④的操作是__________经干燥得Na2S2O4·2H2O样品。
(6)为了测定Na2S2O4·2H2O样品纯度,取mg样品溶解在足量的甲醛溶液中,配制成100.00mL溶液。取10.00mL溶液于锥形瓶中,用cmol/L碘标准液滴定至终点,消耗标准液的体积为VmL。测定过程中,发生的反应:Na2S2O4+2HCHO+H2O═NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O═NaHSO4+HCHO+4HI,则样品中Na2S2O4·2H2O的纯度为____。
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐是___(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
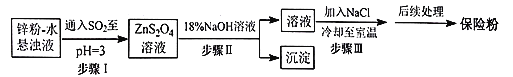
①工业上常将锌块进行预处理得到锌粉-水悬浊液,其目的是__。
②步骤Ⅰ中发生反应的化学方程式为__。
③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是__,“后续处理”最终要加入少量的Na2CO3固体,其原因是__。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___。
(4)有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8),并获得中国专利。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为__,通过阳离子交换膜的离子主要是Na+,其迁移方向是__(填“a到b”或“b到a”)。
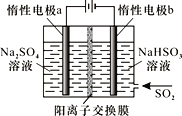
-
保险粉(Na2S2O4)可用作食品保鲜剂、纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。锌粉法制备Na2S2O4的工艺流程如图所示:
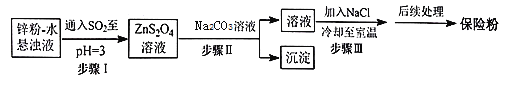
回答下列问题:
(1)实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
(2)工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_________;步骤Ⅰ中发生反应的化学方程式为__________。
(3)步骤Ⅱ中需选用的玻璃仪器除了烧杯、玻璃棒之外,还有__________(填名称)。
(4)在步骤III中加入NaCl的作用是_______,得到的Na2S2O4固体要用乙醇洗涤,其优点是_________。
(5)铁氰化钾可用于分析检测保险粉。铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将 氧化为
氧化为 ,[Fe(CN)6]3−还原为[Fe(CN)6]4−,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L−1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
,[Fe(CN)6]3−还原为[Fe(CN)6]4−,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L−1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
-
某校合作学习小组的同学设计用甲酸钠法制取保险粉(Na2S2O4)并测定其纯度。已知保险粉易溶于水,不溶于甲醇,具有强还原性。回答下列问题:
(1)保险粉的制备。设计的实验装置如下图所示(夹持和加热装置省略):
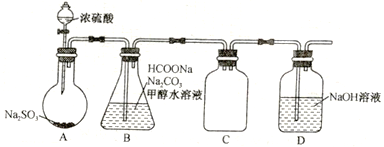
①盛放浓硫酸的仪器名称为____________,装置A是为了制备______(填化学式)。
②装置B中发生反应的离子方程式为_____________________________________________,该反应温度需控制在70~75℃ 进行,适宜的加热方式是_____________,用甲醇水溶液代替水的目的是______________________________。
③装置C 的作用是________________;装置D的作用是__________________________。
(2)产品中Na2S2O4的质量分数的测定,其实验步骤如下:
I.准确称取a g产品放入锥形瓶中,加入适量的水使其溶解,然后加入足量甲醛,充分反应;
II.再滴加几滴淀粉溶液,用c mol/L的标准I2溶液滴定,至终点时,消耗V mL I2溶液。
实验中涉及的反应有: Na2S2O4+ 2HCHO+ H2O==NaHSO3·CH2O+ NaHSO2·CH2O;NaHSO3·CH2O +2 I2+2H2O==NaHSO4+HCHO+4HI。
①步骤II滴定至终点的现象是_________________________________________。
②产品中Na2S2O4的质量分数为__________________________ (用含a、c、V的代数式表示)。


2SO3(g),推测此反应的△S(填“>”或“<”) ______0,△H(填“>”或“<”)______0。
 ______
______















