-
制取下列物质一定有氧化还原反应发生的是
A.FeCl3 B.Si C.NH3 D.SO2
难度: 中等查看答案及解析
-
下列物质中,能发生取代反应且无同分异构体的是
A.甲烷 B.乙醇 C.乙酸乙酯 D.乙酸
难度: 中等查看答案及解析
-
在反应“
+化合物Z”中,X可能是
①单质 ②氧化物 ③盐 ④有机物
A.只有①②③ B.只有②③④ C.只有①③④ D.①②③④
难度: 中等查看答案及解析
-
短周期元素X、Y、W、Q在元素周期表中的相对位置如下图所示。常温下,Al能溶于W 的最髙价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.Y的最髙化合价为+6
B.离子半径:W>Q>Y>X
C.氢化物的沸点:Y>Q
D.最髙价氧化物的水化物的酸性:W>Q
难度: 中等查看答案及解析
-
下列实验中,方案I和方案II均可行,且方案II更合理的是
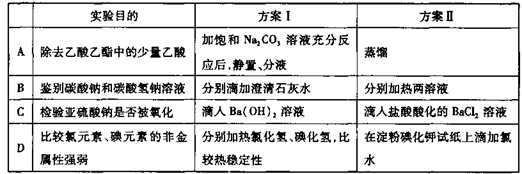
难度: 中等查看答案及解析
-
电浮选凝聚法处理酸性污水的工作原理如图。下列说法不正确的是
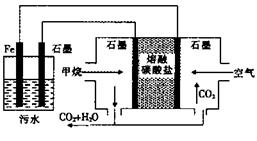
A.铁电极的电极反应式为:Fe—2e—=Fe2+
B.通人甲烷的石墨电极的电极反应式为:CH4+4CO32——8e—=5CO2+2H2O
C.为增强污水的导电能力,可向污水中加人适量工业用食盐
D.若左池石墨电极产生44.8 L气体,则消耗0. 5 mol甲烷
难度: 中等查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液。用 pH传感器测得混合溶液的pH变化曲线如图(已知饱和CO2溶液pH为5.6),下列说法正确的是

A.该Na2CO3溶液的浓度为0.001 mol·L—1
B.在pH =6 时,c(Na+)>c(HCO3—)>c(CO32—)
C.在pH =7 时,c(Na+)=c(Cl—)
D.c→d发生的主要离子反应:CO32—+H+=HCO3—
难度: 中等查看答案及解析