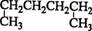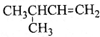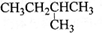-
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______.
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:______.
(3)根据上述反应可推知______.
a.氧化性:KBrO3>H3AsO4 b.氧化性:KBrO3>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:______.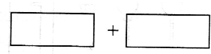
难度: 中等查看答案及解析
-
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=______.
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为______.
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①______②______.
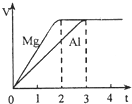
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应.下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是______.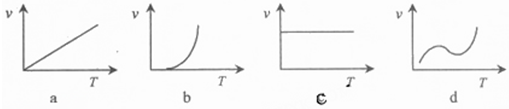
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:______,欲使上述体系中Al3+浓度增加,可加入的物质是______.难度: 中等查看答案及解析
-
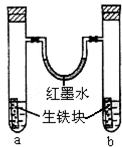
根据硫化氢气体的实验室制法和性质完成下列填空.
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用______.
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图1中选择合适的仪器:______(填编号).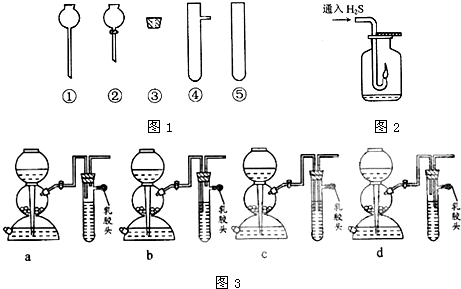
(3)如图2,在一个充满氧气的集气瓶中加入少量品红稀溶液,点燃硫化氢气体.在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是______.
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:______反应过程中,溶液的pH______(填“变大”、“变小”或“不变”).
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置.图3的装置能起到此作用的是______.
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸.当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______.难度: 中等查看答案及解析
-
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁.以下是提纯大理石的实验步骤:
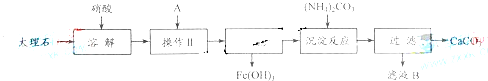
(1)溶解大理石时,用硝酸而不用硫酸的原因是______.
(2)操作Ⅱ的目的是______,溶液A(溶质是共价化合物)是______.
(3)写出检验滤液中是否含铁离子的方法:______.
(4)写出加入碳酸铵所发生反应的离子方程式:______写出滤液B的一种用途:______.
(5)CaO2中一般含CaO.试按下列提示完成CaO2含量分析的实验设计.
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞仪器:电子天平、锥形瓶、滴定管
实验步骤:
①______;②加入______;③加入酚酞,用氢氧化钠标准溶液滴定.
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______.难度: 中等查看答案及解析
-
环氧氯丙烷是制备环氧树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件).
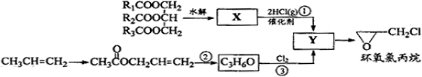
完成下列填空:
(1)写出反应类型:反应①______,反应③______;
(2)写出结构简式:X______,Y______;
(3)写出反应②的化学方程式:______难度: 中等查看答案及解析
-
尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出了两条合成路线).
已知:R-ClR-CN
R-CH2NH2

完成下列填空:
(1)写出反应类型:反应②______,反应③______;
(2)写出化合物D的结构简式:______;
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:______;
(4)写出反应①的化学方程式:______;
(5)下列化合物中能与E发生化学反应的是______.
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):______.难度: 中等查看答案及解析
-
烟气中NOx是NO和NO2的混合物(不含N2O4).
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO______L(标准状况,保留2位小数).
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为______mol/L(保留2位小数).
(3)已知:
NO+NO2+Na2CO3→2NaNO2+CO2 ①
2NO2+Na2CO3→NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气______排放标准(填“符合”或“不符合”),理由:______
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O当烟气中n(NO):n(NO2)=2:3时,吸收率最高.
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1.
计算:
(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数).
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速.计算结果保留1位小数).难度: 中等查看答案及解析
-
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为______;反应③中被破坏的化学键属于______键(填“极性”或“非极性”).
(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是______.
(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第______周期______族.
(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是______.
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b•卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c•卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d•卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
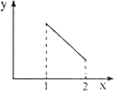
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键______断裂(填“容易”或“不容易”或“不一定容易”).
②卤素单质键能大小与键长的关系为:______.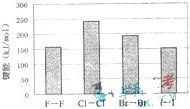
难度: 中等查看答案及解析