-
下列说法不正确的是
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
C. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D. Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠胃道疾病
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A. CO2的电子式:
B. HClO的结构式:H-Cl-O
C. 水分子的球棍模型:
D. 35Cl-离子的结构示意图:
难度: 中等查看答案及解析
-
采用不同的分类方法,可将金属氧化物分为不同的类别。例如,从某种意义上讲,可将Na2O、CuO、MgO、Fe2O3等归为一类,则下列氧化物中与它们同属一类的是
A. CaO B. Na2O2 C. Al2O3 D. Mn2O7
难度: 简单查看答案及解析
-
下列有关物质性质和用途对应具有因果关系的是
A. 二氧化硅熔点高,可用于制光导纤维
B. 次氯酸钙具有强氧化性,可用于消毒杀菌
C. 浓硫酸具有脱水性,可用于干燥气体
D. 氯化铁易水解,可用于腐蚀铜制线路板
难度: 简单查看答案及解析
-
W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
难度: 中等查看答案及解析
-
高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是
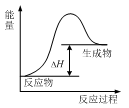
A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性弱于Fe
C. 1molFe3O4参与反应转移8×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3
MgCl2(aq)
Mg
B. NaCl(aq)
NaHCO3
Na2CO3
C. Cu2(OH)2CO3
CuO
Cu(OH)2
D. SO2
NH4HSO3
(NH4)2SO4
难度: 困难查看答案及解析
-
最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2 = 2Na2CO3+C。下列说法错误的是
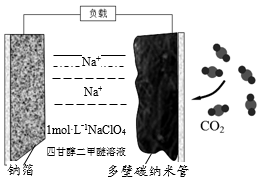
A. 电池工作温度可能在200℃以上
B. 该装置可以将化学能转化为电能
C. 放电时,Na+向正极移动
D. 放电时,正极的电极反应为:4Na++3CO2+4e-=2Na2CO3+C
难度: 中等查看答案及解析
-
下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 若反应过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热
C. 一定温度下,增大反应2BaO2(s)
2BaO(s)+O2(g)容器的体积,平衡不移动
D. 反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH>0能自发进行,可知该反应ΔS>0
难度: 中等查看答案及解析
-
为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验
实验仪器和用品(夹持装置省略)
A
氯化钠溶液的蒸发结晶
烧杯、玻璃棒、酒精灯
B
用盐酸除去硫酸钡中的少量碳酸钡
烧杯、胶头滴管
C
用溴水和CCl4除去NaBr溶液中的少量NaI
烧杯、玻璃棒、胶头滴管、分液漏斗
D
配制 0.5mol·L-1 的硫酸溶液
烧杯、玻璃棒、胶头滴管、容量瓶
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是
A. Na2He是科学家最近合成的新物质,Na2He中各微粒最外层均达到稳定结构
B. 氢氧化钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性
C. 碘晶体是分子晶体,加热升华过程中只需克服原子间作用力
D. 水电解生成氢气和氧气,有化学键的断裂和形成
难度: 困难查看答案及解析
-
一定条件下,0.3 mol N2(g)与0.3 mol H2(g)在体积为1L的密闭容器中发生反应(未配平):N2(g)+H2(g)-→NH3(g),下列示意图合理的是

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水【解析】
CO32-+2H2OH2CO3+2OH-
B. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3- = 9Fe3++NO↑+14H2O
C. 少量的SO2通入NaClO溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+
D. 向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体:Ba2++3OH-+2CO2=BaCO3↓+HCO3-+H2O
难度: 困难查看答案及解析
-
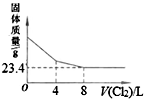
碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g)
2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是

A. 在不同时刻都存在关系:v(N2)=3v(CO)
B. c点切线的斜率表示该化学反应在t时刻的瞬时速率
C. 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
D. 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
难度: 困难查看答案及解析
-
一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
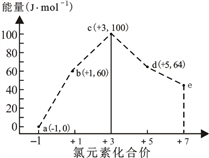
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为20kJ·mol-1
C. b→a+d反应的热化学方程式为3ClO-(aq)=
ClO3-(aq)+2Cl-(aq) △H=-116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为16:1:3
难度: 困难查看答案及解析
-
苯甲酸钠(C6H5COONa,简写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 提高CO2充气压力,饮料中c(A–)减少
C. 当pH为5.0时,饮料中
=0.16
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)–c(HA)
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 31g白磷(
)分子中含有1 NA 个P-P键
B. 1molFeI2与1molCl2反应时转移的电子数为3NA
C. 标准状况下,4.48LCH4和乙烯(CH2=CH2)的混合气体完全燃烧,产生的水中所含O-H键数目为0.8NA
D. 常温下,将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
在常温下,0.100 0 mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
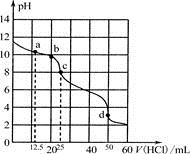
A. a点:c(CO32-)>c(HCO3-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
难度: 极难查看答案及解析
-
将16.8 g铁和0.3 mol Br2充分反应,加水溶解后过滤,向滤液中通入 a mol Cl2。下列叙述不正确的是
A. 当a=0.1时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.45时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br-有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
难度: 极难查看答案及解析
-
装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
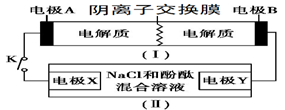
A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
难度: 困难查看答案及解析
-
某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
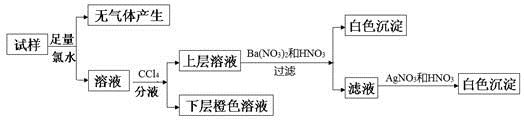
则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
难度: 简单查看答案及解析
-
某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:
下列说法正确的是

A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
难度: 极难查看答案及解析
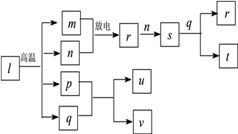
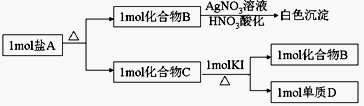
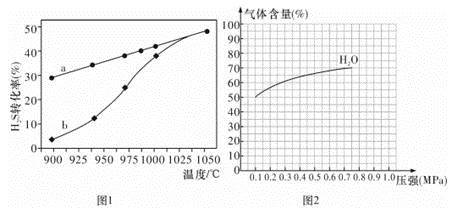

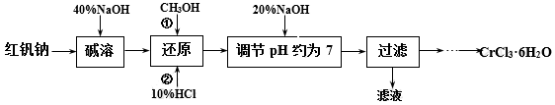 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O