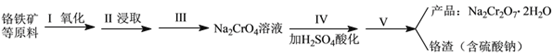-
氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O 2CrO42-+2H+;
2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
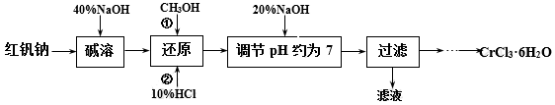
(1)碱溶的目的是____,所加40%NaOH不宜过量太多的原因是____。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,该反应的离子方程式为____。
(3)使用下列用品来测定溶液的pH,合理的是____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
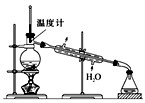
①该装置中存在的错误是____。
②在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:____。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
-
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
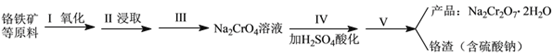
(1)步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
(2)在常温下该反应速度极慢,下列措施中能使反应速率增大的是_____________________________ 。
a.升高温度 b.及时转移生成CO2 c.将原料粉碎 d.增加纯碱的用量
(3)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是__________________________、____________________________。
(4)步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_____________________________________。
(5)步骤Ⅳ酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1H2SO4溶液,在 60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤1中所加的碳酸钠溶液中需要煮沸,其目的是_______;
(3)在步骤3中,“一系列操作”依次为______、_______和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的操作方法是_____。
-
工业上以铬铁矿(主 要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为
要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为
(1)4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是Na2CO3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成13.1g的Na2Cr2O7时共转移0.35 mol电子
-
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
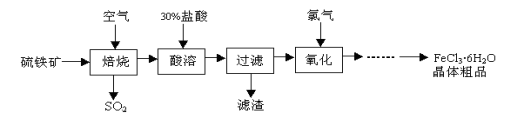
请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2 +8O2 + 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
+ 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
(2)“酸溶”中反应的化学方程式为 。
(3)“过滤”后滤液中金属阳离子有 。
(4)“氧化”中反应的离子方程式为 。
(5)该工艺流程中产生的SO2会污染空气,常用烧碱溶液来吸收。写出吸收过程中反应的化学方程式 。
-
(8分)某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
-
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
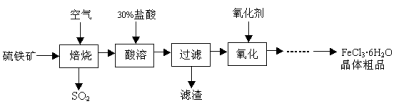
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
-
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
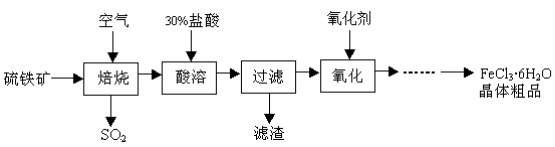
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式 ;
(2)“酸溶”中反应的离子方程式为 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2 ②品红③石灰乳 ④O2,用于吸收SO2最好的是 。
-
实验是化学学科的一种重要学习手段,硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.(查阅资料)
A.Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
B.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
C.Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.(产品制备)实验装置如图所示(省略夹持装置):
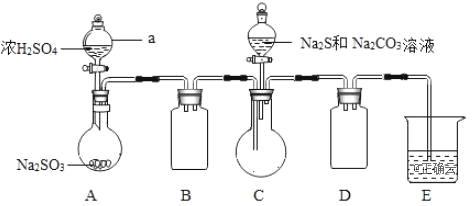
实验步骤:
(1)组装好仪器后,接下来应该进行的实验操作是___,仪器a的名称是___;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
其作用是____。
(2)已知Na2S2O3·5H2O的溶解度随温度升高显著增大,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经___(填操作方法)、冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有___。
Ⅲ.(探究与反思)
(3)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,是否说明一定有Na2SO4___(填“是”或“否”),过滤,向白色沉淀中加入足量稀盐酸,如果产品中含有Na2SO3和Na2SO4,则加入稀盐酸产生的现象是___;
(4)为减少装置C中生成Na2SO4的量,应该先打开___(填“A”或“C”)装置上的活塞。这样做的目的是___。
-
硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如图所示(省略夹持装置):
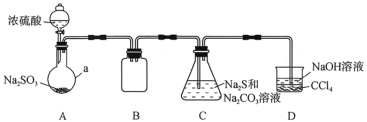
(查阅资料)
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是___;B的作用是___。
(2)C中反应氧化剂与还原剂的物质的量之比为___。
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的___(填试剂名称),若___(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、___、___。经计算,样品中硫代硫酸晶体的百分含量为___。(保留三位有效数字)
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O2CrO42-+2H+;