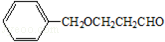-
下列有关说法正确的是( )
A.铜的金属活动性比铁弱,可以用铜罐代替铁罐盛装和运输浓硝酸
B.明矾净水与铁粉作食品的脱氧剂都利用了物质的还原性
C.钢瓶可以运输液氯
D.用氧化铝制成的耐高温坩埚可以用于熔融氢氧化钠
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A.过量C02通入氢氧化钙溶液中:CO2+OH﹣═HCO3﹣
B.Na202加入H2180中:2Na2O2+2H218O═4Na++4OH﹣+18O2↑
C.硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D.水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32﹣+H2SiO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值.下列叙述正确的是( )
A.完全氧化56g Fe需要消耗氯气33.6 L
B.7.8g Na2O2溶于100ml水,转移电子数为0.1NA
C.向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol
D.利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9NA电子
难度: 中等查看答案及解析
-
如图所示的实验,发现烧杯中酸性KMn04溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeS04溶液,溶液呈血红色.判断下列说法中不正确的是( )
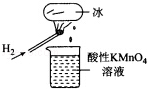
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等
C.将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性
D.酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣
C.无色透明的溶液中:MnO4﹣、SO42﹣、Na+、H+
D.
=0.1 mol/L的溶液:Na+、K+、SiO32﹣、NO3﹣
难度: 中等查看答案及解析
-
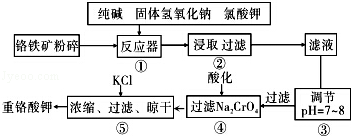
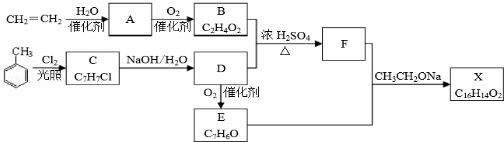
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
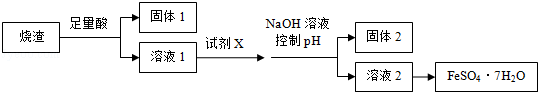
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O
难度: 困难查看答案及解析
-
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
A.反应后溶液中铁元素可能以Fe2+形式存在
B.反应后溶液中c(N03﹣)=0.85 mol/L
C.反应后的溶液最多还能溶解1.4 g Fe
D.1.12 L气体可能是NO、NO2的混合气体
难度: 困难查看答案及解析