-
重铬酸钾是工业生产和实验室的重要氧化剂,重铬酸钾的溶解度随温度影响较大.工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图.涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
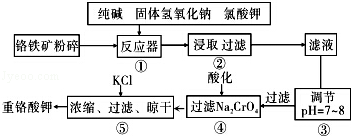
(1)碱浸前将铬铁矿粉碎的作用是 .
(2)步骤③调节pH后过滤得到的滤渣是 .
(3)操作④中,酸化时,CrO42﹣转化为Cr2O72﹣,写出平衡转化的离子方程式 .
(4)用简要的文字说明操作⑤加入KCl的原因 .
(5)已知在常温下FeS 的 Ksp=6.25×10 ﹣18,H2S 饱和溶液中 c (H+)与 c (S2﹣)之间存在如下关系:c2 (H+)•c(S2﹣)=1.0×10﹣22.在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为 .
-
( 9分)重铬酸钾(K2Cr2O7)是重要氧化剂,重铬酸钾的溶解度受温度影响较大,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2•Al2O3)为原料生产它。实验室模拟工业上用铬铁矿制 K2CrO7的主要工艺流程如下图。涉及“碱熔”的主要反应为:
6 FeO•Cr2O3 + 24NaOH + 7KC1O3 = 12NaCrO4 + 3Fe2O3 + 7KCl + 12H2O
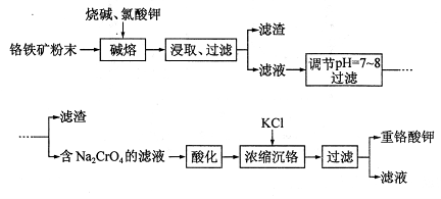
(1)使用粉末状铬铁矿的目的是 。
(2)调节pH后,过滤得到的滤渣是 (填化学式)。
(3)酸化Na2CrO4溶液时,其平衡转化的离子方程式为 。
(4)称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加入10 mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100 mL 水,加人3mL淀粉溶液(作指示剂),用0.1200 mol/LNa2S2O3标准溶液滴定( I2 + 2S2O2- 3= 2I-+S4O2- 6),用去20.00mL ,则该样品的纯度为 。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O。

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:______________、________________。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,写出该反应的化学方程式: 。
简述检验溶液中是否存在Fe3 +的方法是: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(5)铬(Cr)与铝的性质相似,试写出Cr(OH)3 溶于NaOH 溶液所发生反应的离子反应方程式: 。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
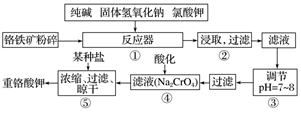
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
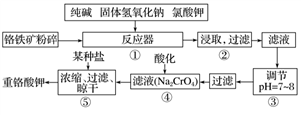
请回答下列问题:
(1)配平反应器①中的反应
____FeO·Cr2O3+ NaOH+ KClO3= Na2CrO4+ Fe2O3+ KCl+ H2O
(2)在反应器①中,除了有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_______________________
______________________________________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:________________________________________________________________________。
(4)步骤③调节pH后过滤得到的滤渣是______________简要叙述步骤③的目的:__________________________________________________。
(5) 步骤④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
(6)酸化时,CrO 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:_________________________。
,写出平衡转化的离子方程式:_________________________。
-
(15分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
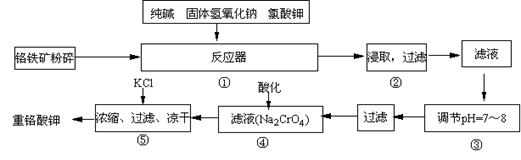
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
________。
(2)操作③的目的是什么,用简要的文字说明:________
________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)________ %(保留小数点后两位)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
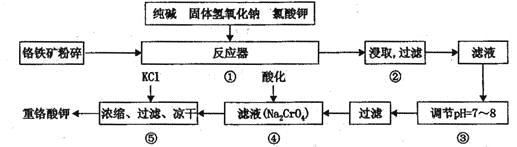
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3  12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
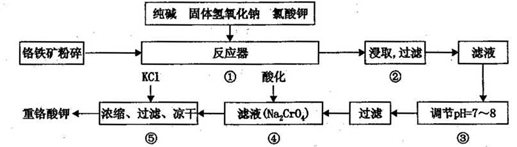
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: _______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加 入10 mL 2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
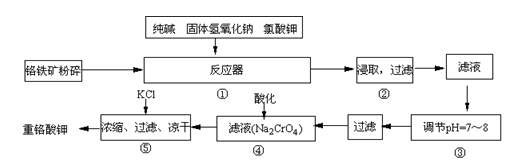
⑴在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
⑵NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
________。
⑶操作③的目的是什么,用简要的文字说明:________。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
________。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)________。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的
主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
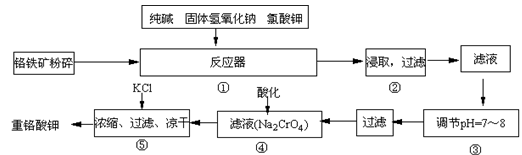
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________。
(2)操作③的目的是什么,用简要的文字说明:________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:________。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)________。









