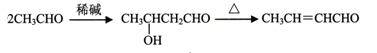-
辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。辉铜矿的湿法冶炼目前国内外都处于探索阶段。自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
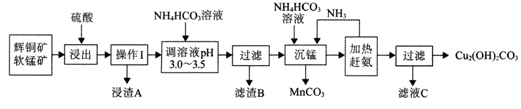
已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,Kap[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是__________。
(2)写山浸出时主要反应的离子方程式_____________。
(3)浸渣A的主要成分为_______;调溶液pH 3.0-3.5的目的是除去______离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=__________。
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为_________________。
(5)从滤液C中提取硫酸氨晶体的步骤为_______、_______、过滤、洗涤、干操。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有________、_____。(列举其中2条)
-
工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
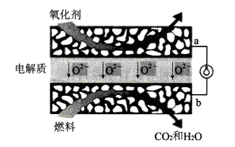
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。
(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g)  CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。
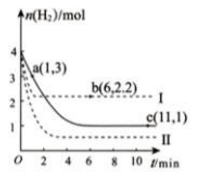
④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
-
三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料。加热至110℃时失去结晶水,230℃时分解。极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]·3H2O 2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
已知:
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]·3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4·2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究。回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50 g FeC2O4·2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右。充分反应后,沉淀转化为氧氧化铁。
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解。用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体。
(1)完成步骤(i)发生反应的离子方程式:
____FeC2O4·2H2O+______C2O42-+____H2O2=___Fe(OH)3+4[Fe(C2O4)3]3-+____H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是________。
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率______________。
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液。量取25.00 mL 溶液置于锥形瓶中,加入5.0 mL 1mol/L H2SO4,用0.06mol/L的KMnO4 溶液滴定。滴定终点时消耗KMnO4溶液20.00mL。
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是_______________,滴定时发生反应的离子方程式为_____。
(5)样品中草酸根的物质的量为_______;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是_______(填字母)。
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解。
(6)为了验证此推测是否正确,可选用的试剂是____________。
-
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________。
(2) RO3-的立体构型是______________,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____(填元素符号), 原因是_____。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
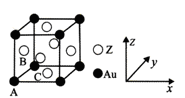
① 该晶体中,Z与Au的原子个数比为_________;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______nm。(列出表达式即可)
-
[化学―选修5: 有机化学基础]
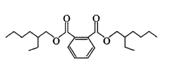
某塑化剂DEHP的结构简式如右图所示,其合成路线如下:
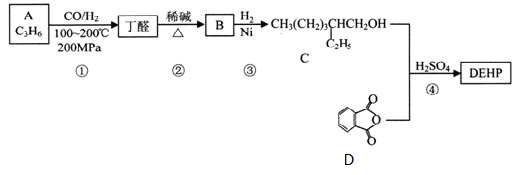
已知:① A 的核磁共振氢谱有三组峰。
② 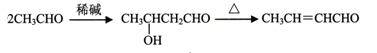
回答下列问题:
(1)A的结构简式为_____,B的结构简式为_________。
(2)C的化学方名称为_______,反应分两步进行,其反应类型分别为_____、_____。
(3)DEHP在稀硫酸催化下水解的化学方程式为____________。
(4)写出DEHP酸性水解产物中满足下列条件的所有同分异构体的结构简式(不考虑立体异构)_______。
a.属于芳香族化合物 b.核磁共振氢谱有两组峰
(5)写出以D和乙烯为原料(其他无机试剂任选)制备聚邻笨二甲酸乙二醇酯的合成路线___。
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)