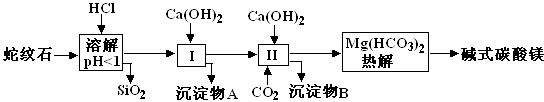
-
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起( )
A.溶液的pH增大
B.CH3COOH的电离程度增大
C.溶液的导电能力减小
D.溶液的c(OH-)减小难度: 中等查看答案及解析
-
下列说法正确的是( )
A.凡是生成两种或两种以上的物质的反应都是分解反应
B.一种元素可能有多种氧化物,但一种化合价只对应一种氧化物
C.有些化学反应不属于化合、分解、置换、复分解反应中的任何一种反应
D.分散质直径介于1nm-10nm之间的分散系称为胶体难度: 中等查看答案及解析
-
下列各图所示的实验原理、方法、装置和操作正确的是( )

A.①干燥Cl2
B.②检验K2CO3中的K+
C.③石油的蒸馏
D.④吸收NH3难度: 中等查看答案及解析
-
下列判断正确的是( )
第Ⅰ栏 第Ⅱ栏 判断 A 铁与稀硫酸反应可生成氢气 铁丝在氧气中点燃生成Fe3 O4 Ⅰ对;Ⅱ对 B Na2CO3溶液中,c(Na+)=2c(CO3 2-) 21H的中子数和质子数相等 Ⅰ对;Ⅱ错 C Na2O2与H2O反应的化学方程式为Na2O2 +H2O=2NaOH+O2↑ 常温下可用铝罐贮存浓硝酸 Ⅰ对;Ⅱ对 D 用AgNO3溶液和稀硝酸可区分Na2CO3、NaBr溶液 25℃时,改变醋酸溶液的浓度,醋酸的电离平衡常数也改变 Ⅰ对;Ⅱ对
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列叙述中完全正确的一组是( )
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA
④常温常压下,16g O3所含的原子数为NA
⑤1mol C10H22分子中共价键总数为31NA
⑥1mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L水中含分子数为NA.
A.①②③④⑤
B.②④⑤⑥⑦
C.②④⑤
D.①②⑤难度: 中等查看答案及解析
-
用4种溶液进行实验,下面“操作及现象”与“溶液”对应关系错误的是( )
A.通入CO2,溶液变浑浊.继续通CO2至过量,浊液不变澄清.是NaAlO2溶液
B.通人CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.是Na2SiO3溶液
C.通人CO2,溶液变浑浊.再加人品红溶液,红色褪去.是Ca(ClO)2溶液
D.通人CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊.是Ca(OH)2溶液难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.已知某镍镉电池中电解质溶液为KOH溶液,其充放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2,有关该电池的说法错误的是( )
A.充电时阳极反应:Ni(OH)2+OH-+e-→NiOOH+H2O
B.充电过程是电能转化为化学能的过程
C.放电时负极上发生氧化反应,电极附近溶液的碱性减弱
D.放电时电解质溶液中OH-向负极移动难度: 中等查看答案及解析