-
下列关于实验操作的叙述中正确的是( )
①从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;
②可燃性气体点燃之前必须验纯;
③用胶头滴管向试管中滴加液体,一定要将胶头滴管伸入试管中;
④用托盘天平称量固体药品时,应左物右码;
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却;
⑥选用100mL量筒量取4.53mL稀硫酸
A.①③④⑤ B.①③④⑥ C.②④⑤ D.以上答案均不正确
难度: 中等查看答案及解析
-
在氧化还原反应中,水作为氧化剂的是( )
A.C+H2O(g)CO+H2 B.3NO2+H2O===2HNO3+NO
C.2Na2O2+2H2O===4NaOH+O2↑ D.2F2+2H2O===4HF+O2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO===CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+===Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2===2Fe3++2Cl-
难度: 中等查看答案及解析
-
现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为L
B.加入0.05mol·L-1盐酸0.125VL
C.加入10mol·L-1盐酸0.1VL,再稀释至1.5VL
D.标准状况下通入11.2L氯化氢气体
难度: 中等查看答案及解析
-
若某氖原子的质量ag,12C原子的质量是bg,NA表示阿伏加德罗常数,下列说法不正确的是( )
A.该氖原子的相对原子质量是12a/b B.该氖原子的摩尔质量是aNA g
C.Wg该氖原子的物质的量是W/(aNA)mol D.Wg该氖原子所含质子数为10W/a
难度: 中等查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O===HBrO+HCl,下列有关BrCl的性质的叙述中不正确的是( )
A.是较强的氧化剂
B.是一种化合物
C.能使湿润的淀粉碘化钾试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O(g)发生反应:CO(g)+H2O(g)
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A.在该温度下平衡常数K=1 B.平衡常数与反应温度无关
C.CO的转化率为50% D.其他条件不变改变压强平衡不移动
难度: 中等查看答案及解析
-
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
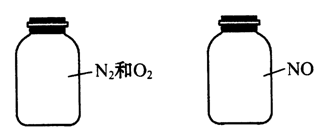
A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.摩尔质量相等
难度: 中等查看答案及解析
-
当溶液中X2O和SO离子数之比为1:3时,正好完全发生氧化还原反应,X在还原产物中的化合价为( )
A.+1 B.+2 C.+3 D.+4
难度: 中等查看答案及解析
-
有A、B、C、D四种物质,已知它们能发生下列变化:
①A2++B===B2++A ②A2++C===C2++A
③B2++C===C2++B ④C2++D===D2++C
由此可推知,各物质的氧化性、还原性强弱顺序正确的是( )
①氧化性:A2+>B2+>C2+>D2+
②氧化性:D2+>C2+>B2+>A2+
③还原性:A>B>C>D
④还原性:D>C>B>A
A.①③ B.②③ C.②④ D.①④
难度: 中等查看答案及解析
-
在恒温、恒容下,发生如下反应:2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol·L-1;途径Ⅱ:C、D的起始浓度分别为2 mol·L-1和6 mol·L-1。以下叙述正确的是( )
A.达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率
B.达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C.两途径最终达到平衡时,体系内各组分的百分含量相同
D.两途径最终达到平衡时,体系内各组分的百分含量不相同
难度: 中等查看答案及解析
-
将O2、NO、NH3、HCl分别收集于等体积的四个容器里,把四个容器用导管连成一个整体,若使各气体充分混合(保持温度不变),混合后容器中的压强与原容器中的压强之比为( )
A.1:1 B.1:2 C.3:4 D.3:8
难度: 中等查看答案及解析
-
向Fe2O3和铁粉组成的混合物中,加入适量的稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4:1,那么在反应中,Fe2O3、Fe、H2SO4的物质的量之比为( )
A.1:1:1 B.1:2:4 C.1:2:3 D.2:3:5
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0) ,某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
难度: 中等查看答案及解析
-
已知:2CO (g)+O2(g)===2CO2(g);ΔH=-566 kJ·mol-1
N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1
则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1
C.-746 kJ·mol-1 D.+746 kJ·mol-1
难度: 中等查看答案及解析
-
俗话说“卤水点豆腐,一物降一物”,这其实说的就是胶体的聚沉。向胶体中加入酸、碱、盐,能使胶粒所带电荷被中和,从而“聚集长大”直至生成沉淀。使一定量的胶体溶液在规定时间内开始凝聚所需酸、碱、盐等的浓度(mmol/L)称做“聚沉值”。电解质的聚沉值越小,表示其凝聚能力越大。实验证明,凝聚主要取决于胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为(注:Fe(OH)3胶粒带正电荷)( )
A.NaOH B.AgNO3 C.BaCl2 D.Na3PO4
难度: 中等查看答案及解析
-
香烟烟雾中含有CO、CO2、SO2、H2O等气体。用a.无水硫酸铜、b.澄清石灰水、c.红热氧化铜、d.生石灰、e.酸性品红溶液等可将其一一检出,检出的正确顺序是( )
A.混合气→a→c→b→a→d→c B.混合气→c→d→e→e→a
C.混合气→a→e→e→b→d→c D.混合气→b→e→a→d→c
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
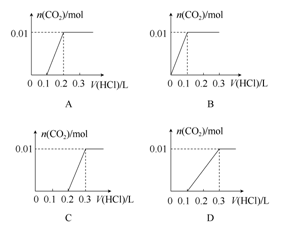
难度: 中等查看答案及解析
-
有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A.40 mL B.72 mL
C.80 mL D.128 mL
难度: 中等查看答案及解析
-
(8分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
___________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
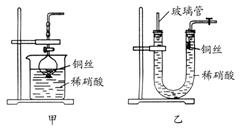
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)
A.铁 B.铝
C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________________________________________________(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。
长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________mL O2才能使NO全部溶于水。
难度: 中等查看答案及解析
-
用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是______________。
甲:铜硝酸铜
乙:铜硝酸铜
丙:铜氯化铜硝酸铜
丁:铜氧化铜硝酸铜
难度: 中等查看答案及解析