-
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
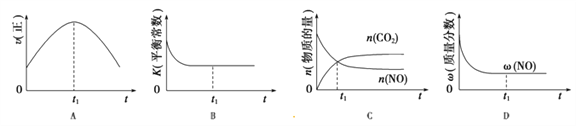
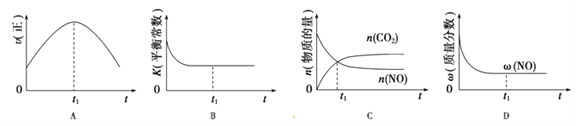
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【答案】 4 D 不能 C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ•mol-1 BD C(s)+2NO(g)=CO2(g)+N2(g) 4 < 80%
【解析】(1)根据表格提供的离子可知,NH4+ 水解导致试样溶液呈酸性,再根据电荷守恒可知,c(K+)+c(NH4+ )+c(Na+)+c(H+)=2c(SO42-)+c(Cl-)+c(NO3-),将表格中的数据代入得H+离子浓度为10-4,则PH值为4。
(2)①在恒容密闭容器中,混合气体的质量和体积始终不变,混合气体的密度也始终不变,密度不能作为达到平衡状态的判据,A项错误;该反应是气体体积不变的可逆反应,根据M=质量/n,则混合气体的平均分子量始终不变,不能作为达到平衡的判据,B项错误;N2、O2、NO的物质的量之比为1∶1∶2不能说明反应各物质的浓度保持不变,C项错误;氧气的百分含量不再变化,说明反应达到平衡状态,D项正确;答案选D。
②化学反应2CO(g)=2C(s)+O2(g)是一个熵减、吸热的反应,则△H-T△S>0,所以该设想不能实现。
(3)已知:①H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1、②C(s)+1/2O2(g) =CO(g) △H =-110.5kJ·mol-1,利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJ•mol-1)-(-241.81kJ•mol-1)=+13l.3 kJ•mol-1,所以焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ•mol-1 。
(4)可逆反应达化学平衡状态时正逆反应速率不再变化,A项错误;该物质的浓度在化学平衡时保持不变,所以K不再变化,B项正确;对于恒容容器而言,各物质的物质的量不再改变,C项错误;平衡时NO的质量分数不再改变,D项正确,答案选BD。
(5)①由表中数据可知,C、NO、E、F的化学计量数之比为0.040:0.080:0.040:0.040 =1:2:1:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,且该反应为可逆反应,则反应方程式为C(s)+2NO(g) ⇌ CO2(g)+N2(g)。
②从表中数据可知T1℃时的平衡浓度c(NO)=0.004mol/L,c(N2)=c(CO2)=0.008 mol/L,则T1℃时该反应的平衡常数为K1=(0.008×0.008)÷(0.004×0.004)=4;从T1到T2,NO的浓度增大,说明平衡逆向移动,若T1<T2,升高温度,平衡向吸热反应方向移动,则该反应的正向为放热反应,则△H < 0。
③在T1时,K=4,设NO的转化率为x,根据三段式解答:
C(s)+2NO(g) ⇌ CO2(g)+N2(g)
起始浓度 0.04 0 0
变化浓度 0.04x 0.02x 0.02x
平衡浓度 0.04-0.04x 0.02x 0.02x
K=[0.02x×0.02x]÷[(0.04-0.04x)×(0.04-0.04x)=4,解得x=0.8,即达到新的平衡时,NO的转化率为80%。
【题型】填空题
【结束】
10
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
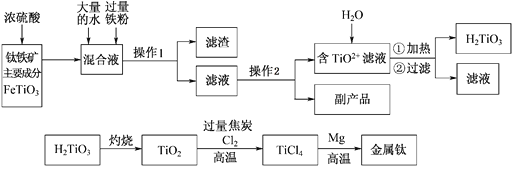
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
-
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
【答案】 漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
【解析】钛铁矿用浓硫酸溶解,浓硫酸具有酸性,强氧化性,反应的主要产物是TiOSO4和FeSO4,还可能有少量Fe2(SO4)3;向所得溶液中加入大量水稀释后,加入过量铁粉还原Fe3+,过滤得到滤液中只含有TiOSO4和FeSO4;TiOSO4水解过滤后得到H2TiO3,H2TiO3加热灼烧得到TiO2,加入Cl2、过量碳高温反应生成TiCl4,TiCl4和Mg高温反应得到MgCl2和Ti。
(1)操作1为过滤,所需玻璃仪器有烧杯、漏斗、玻璃棒,故还缺少的仪器为:漏斗和玻璃棒;故答案为:漏斗、玻璃棒;
(2)TiOSO4遇水会水解,水解方程式为TiO2++2H2O⇌H2TiO3+2H+,水解是吸热过程,加热能促进水解;加水稀释,促进水解。
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动;
(3)在流程中,金属镁置换出钛单质,反应方程式为:TiCl4+2Mg Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
 Ti+4NaCl。
Ti+4NaCl。
故答案为:TiCl4+4Na Ti+4NaCl;
Ti+4NaCl;
(4)根据题意可知,TiO2作阴极,得电子,被还原得到单质Ti,则阴极电极反应式为:TiO2 +4e-=Ti+2O2-。故答案为:TiO2 +4e-=Ti+2O2-;
(5)FeC13有强的氧化性,腐蚀橡胶,且其溶液呈酸性,所以选择酸式滴定管。用KSCN溶液作指示剂,TiO2+反应完之前溶液为无色。当反应完,再滴入1滴FeC13溶液,溶液立即变红色,且半分钟后溶液颜色不褪色,到达滴定终点,停止滴定。
滴定过程中消耗n(FeC13)=0.1mol/L×0.03L=0.003mol。根据反应方程式可得出TiOSO4与Fe3+的关系式:TiOSO4~Ti3+~Fe3+,即滴定过程中n(FeC13)= n(TiOSO4)= 0.003mol。原待测液为10mL,稀释至100mL后,取2omL溶液进行滴定实验。所以原10mL待测液中含n(TiOSO4)= 0.003mol× =0.015mol,c(TiOSO4)=
=0.015mol,c(TiOSO4)=  =1.5 mol•L-1。
=1.5 mol•L-1。
故答案为:酸式滴定管;溶液由无色变成红色且半分钟不褪色 ;1.5 mol•L-1.
【题型】综合题
【结束】
11
Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
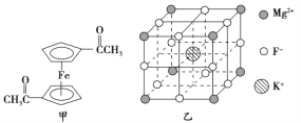
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。

-
Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。
【答案】 1s22s22p63s23p63d5(或3d5) sp3、sp2 N>O>C CO(或N2) 4∶3 KMgF3
【解析】(1)Fe的原子序数为26,Fe3+的基态核外电子排布式为1s22s22p63s23p63d5(或3d5)。
(2)根据图中乙酰基二茂铁的结构可知,碳原子的杂化方式有两种。其中形成碳氧双键的碳原子和五元环上的碳原子杂化方式是sp2杂化,而-CH3上的碳原子杂化方式是sp3杂化。
(3)根据元素周期律,可知同周期元素原子第一电离能随着原子序数的增加逐渐增大,由于原子轨道上电子处于全满、半满和全空时较稳定,所以第ⅡA、ⅢA族以及第ⅤA、ⅥA主族存在反常,即同周期元素第ⅡA族的第一电离能大于第ⅢA族的第一电离能,第ⅤA族的第一电离能大于第ⅥA族的第一电离能,因此 、
、 、
、 原子的第一电离能由大到小的顺序是N>O>C。
原子的第一电离能由大到小的顺序是N>O>C。
(4)配合物K3Fe(CN)6的配体是CN-,有14个电子,因此与其互为等电子体的分子有两种:CO或N2;(CN)2是直线型分子且具有对称性,可以判断碳氮之间形成三键,碳碳之间为单键连接,其结构式为N≡C-C≡N,因此 键有4个,
键有4个, 键有3个,个数比为
键有3个,个数比为 。
。
(5)由晶胞结构图可知:K+位于体心,F-位于棱上,Mg2+位于顶点,因此每个晶胞中有1个K+、1/4×12=3个F-,1/8×8=1个Mg2+,则该晶体的化学式为KMgF3。
【题型】综合题
【结束】
12
某树脂的合成线路如下:
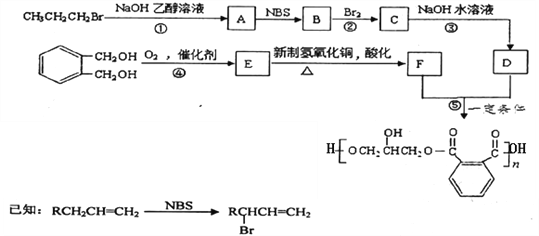
(1)B中含有的官能团的名称是________________________。
(2)反应①、③的有机反应类型分别是________________、____________________。
(3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是_______________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.可以用NaHCO3鉴别E和F
c.B分子存在顺反异构
(5)写出反应⑤的化学方程式______________________________________________。
(6)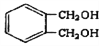 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀






 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。