-
(本题满分18分)钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
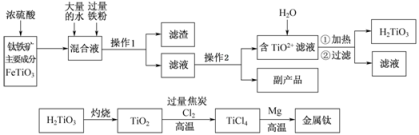
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ________________________________________________ ,操作2是 ________________ 、过滤,副产品主要成分的化学式为 ________________________________ 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 ________________________ 。
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是________________________________________________________,如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为 ________________________________________________ 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用 ________________________________ (填一种玻璃仪器的名称)滴加0.1000mol•L﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+,当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是________________________________________________ 。
-
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
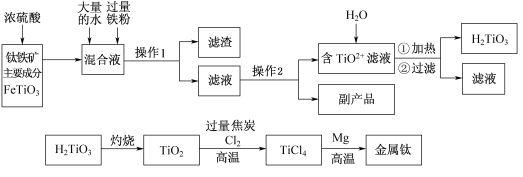
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝与锌之间,估计钛能耐腐蚀的原因之一是 。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
-
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
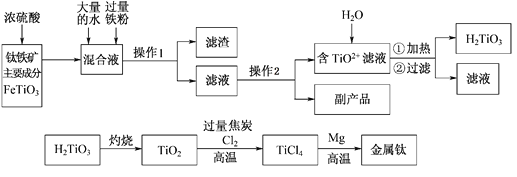
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
【答案】 漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
【解析】钛铁矿用浓硫酸溶解,浓硫酸具有酸性,强氧化性,反应的主要产物是TiOSO4和FeSO4,还可能有少量Fe2(SO4)3;向所得溶液中加入大量水稀释后,加入过量铁粉还原Fe3+,过滤得到滤液中只含有TiOSO4和FeSO4;TiOSO4水解过滤后得到H2TiO3,H2TiO3加热灼烧得到TiO2,加入Cl2、过量碳高温反应生成TiCl4,TiCl4和Mg高温反应得到MgCl2和Ti。
(1)操作1为过滤,所需玻璃仪器有烧杯、漏斗、玻璃棒,故还缺少的仪器为:漏斗和玻璃棒;故答案为:漏斗、玻璃棒;
(2)TiOSO4遇水会水解,水解方程式为TiO2++2H2O⇌H2TiO3+2H+,水解是吸热过程,加热能促进水解;加水稀释,促进水解。
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动;
(3)在流程中,金属镁置换出钛单质,反应方程式为:TiCl4+2Mg Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
 Ti+4NaCl。
Ti+4NaCl。
故答案为:TiCl4+4Na Ti+4NaCl;
Ti+4NaCl;
(4)根据题意可知,TiO2作阴极,得电子,被还原得到单质Ti,则阴极电极反应式为:TiO2 +4e-=Ti+2O2-。故答案为:TiO2 +4e-=Ti+2O2-;
(5)FeC13有强的氧化性,腐蚀橡胶,且其溶液呈酸性,所以选择酸式滴定管。用KSCN溶液作指示剂,TiO2+反应完之前溶液为无色。当反应完,再滴入1滴FeC13溶液,溶液立即变红色,且半分钟后溶液颜色不褪色,到达滴定终点,停止滴定。
滴定过程中消耗n(FeC13)=0.1mol/L×0.03L=0.003mol。根据反应方程式可得出TiOSO4与Fe3+的关系式:TiOSO4~Ti3+~Fe3+,即滴定过程中n(FeC13)= n(TiOSO4)= 0.003mol。原待测液为10mL,稀释至100mL后,取2omL溶液进行滴定实验。所以原10mL待测液中含n(TiOSO4)= 0.003mol× =0.015mol,c(TiOSO4)=
=0.015mol,c(TiOSO4)=  =1.5 mol•L-1。
=1.5 mol•L-1。
故答案为:酸式滴定管;溶液由无色变成红色且半分钟不褪色 ;1.5 mol•L-1.
【题型】综合题
【结束】
11
Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。

-
金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):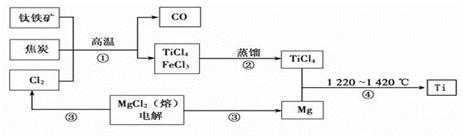
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2 2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ________ ________ ,每生成1mol TiCl4转移________mol电子。
2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ________ ________ ,每生成1mol TiCl4转移________mol电子。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 ________的不同。
(3)步骤④反应的化学方程式为________________________________,该反应在氩气中进行的理由是______________________________________。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有___。
-
(14分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
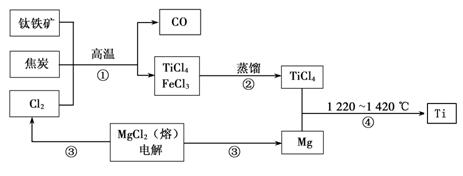
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2 2FeCl3 + 2TiCl4 + 6CO,还原剂是。
2FeCl3 + 2TiCl4 + 6CO,还原剂是。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3________的不同。
(3)步骤④反应的化学方程式为________________________________,该反应在氩气中进行的理由是______________________________________。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有____________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s) +2Cl2 (g)  TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因:________。
TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因:________。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中,碳块为阳极,电极反应式为:2O2ˉ– 4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为。
(7)电解过程中需定期向电解槽中加入碳块的原因是________。
-
金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
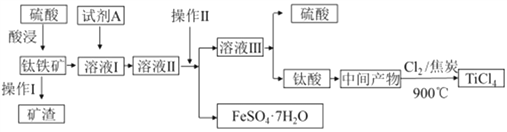
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O 胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)  TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)  TiCl4(g)+O2(g) △ H=+ 151kJ/mol
TiCl4(g)+O2(g) △ H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
方法二: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
-
金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
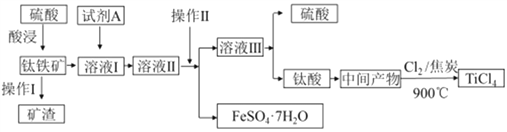
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O 胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)  TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)  TiCl4(g)+O2(g) △ H=+ 151kJ/mol
TiCl4(g)+O2(g) △ H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
方法二: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
-
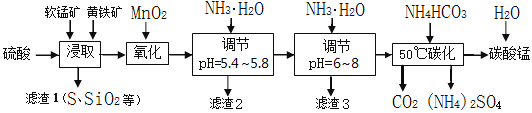
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
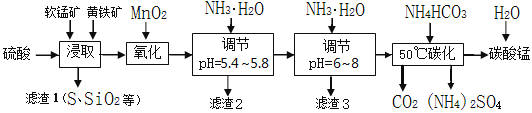
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
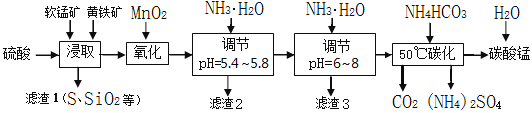
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。

H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
Ti+4NaCl。
Ti+4NaCl;
=0.015mol,c(TiOSO4)=
=1.5 mol•L-1。









