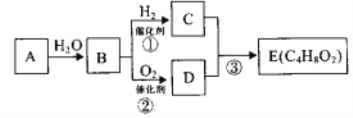
-
《本草纲目》中载有一药物,名“铜青”.藏器日:生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也.铜青则是铜器上绿色者,淘洗用之.时珍曰:近时人以醋制钢生绿,取收晒干货之.后者的反应原理为
A. 析氢腐蚀 B. 吸氧腐蚀 C. 化学腐蚀 D. 置换反应
难度: 中等查看答案及解析
-
在蒸发皿中加热燕干并灼烧下列物质的溶液,可以得到该溶质的固体物质的是
A. 碳酸氢钠 B. 硫酸镁 C. 氯化铝 D. 高锰酸钾
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离出来的c(OH-)=1×10-11mol/L,若向该溶液中滴入2~3滴酚酞,溶液的颜色可能是
A. 只显红色 B. 呈无色 C. 无色或蓝色 D. 红色或无色
难度: 困难查看答案及解析
-
下列各组离子在济液中能大量共存的是
A. Na+、OH-、S2O32-、Cl- B. Fe3+、K+、,AlO2-、HCO3-
C. H+、Al3+、CO32-、SO42- D. H+、Na+、HCO3-、Cl-
难度: 中等查看答案及解析
-
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的
难度: 中等查看答案及解析
-
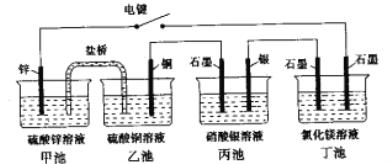
下列实验装置或操作设计正确,且能达到目的的是
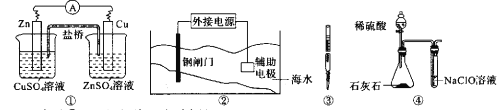
A. 实验①,设计铜锌双液原电池
B. 实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀
C. 实验③,准确量取一定体积K2CrO7标准溶液
D. 实验④,可用于验证酸性:H2SO4>H2CO3>HClO
难度: 中等查看答案及解析
-
相同体移的c(H+)=10-2mol/L的盐酸溶液和醋酸溶液分别跟等质量的锌充分反应,下列说法错误的是
A. 刚开始时两种溶液中产生H2的速率相同
B. 若有一种溶液中锌有剩余,则有剩余的是盐酸溶液
C. 若两种溶液中锌均有剩余。则两者产生等量的氢气
D. 若两种溶液中锌均无剩余,则两者产生等量的氢气
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)
2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
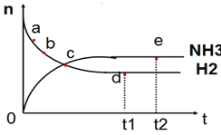
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
难度: 中等查看答案及解析
-
次磷酸钴[Co(H2PO2)2·6H2O]可用于化学电镀,共饱和溶液的pH约为6;利用电渗析法可在产品室析出高纯[Co(H2PO2)2·6H2O]电渗析原理如图所示。则阳离子交换膜有
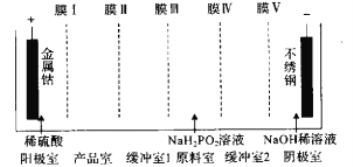
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
实验室采用HCl气体“置换“除水,开华相结合的方法从市售的氯化锌制各高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl].下列说法不正确的是
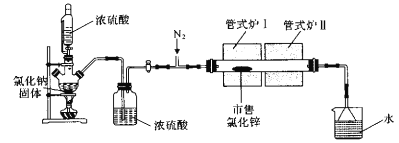
A. 恒压漏斗的作用是平衡气体压强
B. 在尾气吸收装置前应增加一个干燥装置
C. 管式炉Ⅰ采用的升温方式是阶段式升温
D. 实验时,应先徽去管式炉Ⅰ,再撒去管式炉Ⅱ
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2
2VO2+SO3(快) 4VO2+O2
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
难度: 中等查看答案及解析
-
298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
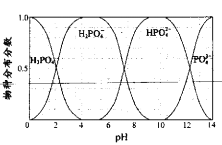
A. K(H3PO4)的数量级为10-8
B. Na2HPO4溶液中:c(PO43-) <c(H2PO4-)
C. pH=7时c(H2PO4-)>c(HPO42-)
D. NaH2PO4溶液显碱性
难度: 中等查看答案及解析
-
现有的氦合成气,液休燃料合成气制各工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备复合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是
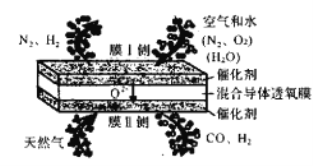
A. O2和H2O均发生还原反应
B. 膜Ⅰ侧相当于原电池的正极
C. 膜Ⅱ侧发生的反应为: CH4+O2--2e-=2H2+CO
D. 膜Ⅱ侧消耗CH4与膜Ⅰ侧生成H的物质的量之比为12
难度: 中等查看答案及解析
-
在一固定休积的密闭容器中,充入2molA和1molB,发生如下反应2A(g)+B(g)
xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
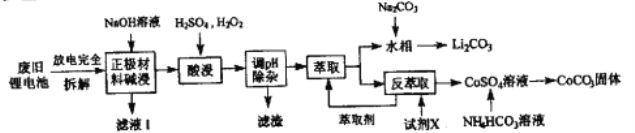

 Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。