-
美国科学家最近发明了利用眼泪来检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20 nm ~60 nm )。下列有关说法错误的是 ( )
A. 检测时NaAuCl4发生氧化反应 B. 葡萄糖和果糖互为同分异构体
C. 葡萄糖是多羟基醛 D. 纳米金颗粒分散在水中所得的分散系能产生丁达尔效应
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 中子数为20的氯原子:
B. CaCl2的电子式:
C. 比例模型表示甲烷分子或四氯化碳分子

D. 氟离子的结构示意图:
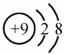
难度: 简单查看答案及解析
-
下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号
事实
推论
A
S(s)+H2(g)=H2S(g) ΔH <0
Se(s)+H2(g)=H2Se(g) ΔH >0
非金属性:S >Se
B
Li在O2中点燃生成Li2O 而Na在O2中点燃生成Na2O2
金属性:Na >Li
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S > C
D
t℃时,Br2 + H2
2HBr K = 5.6×107
I2 + H2
2HI K = 43
非金属性:Br > I
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. Fe
FeCl2
Fe(OH)2
B.
C.
D. CaCO3
CaO
CaSiO3
难度: 中等查看答案及解析
-
室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是( )
A. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+===Fe2+ + 2Fe3+ + 4H2O
B. Na2O2 加入H218O 中:2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2↑
C. 水玻璃中通入过量二氧化碳:Na2SiO3 +CO2 + H2O===2Na+ +CO32- + H2SiO3↓
D. 成分为盐酸的洁厕灵与“84”消毒液混合使用易中毒:C1—+ C1O—+ 2H+=== Cl2↑+H2O
难度: 中等查看答案及解析
-
下列药品和装置合理且能完成相应实验的是( )
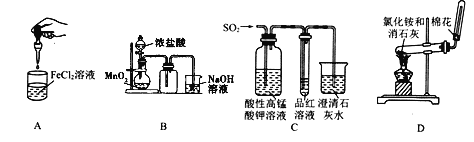
A. 制备氢氧化亚铁 B. 实验室制氯气
C. 检验二氧化硫中是否混有二氧化碳 D. 实验室制取并收集氨气
难度: 中等查看答案及解析
-
玉米芯与稀硫酸在加热加压下反应,可以制得糠醛 (
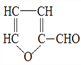 ),糠醛是重要的化工原料,用途广泛。关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛。关于糠醛的说法,不正确的是( )A. 其核磁共振氢谱有3种不同类型的吸收峰
B. 1 mol糠醛可与3 mol H2 发生加成反应
C. 能使酸性高锰酸钾溶液褪色
D. 与苯酚在一定条件下反应得到结构简式为
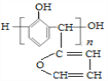 的产物
的产物难度: 中等查看答案及解析
-
下列物质用途或操作正确且与盐类水解有关的一组是( )
①用热饱和硫酸铵溶液清洗铁器表面的铁锈
②用TiCl4水溶液制备TiO2 • xH2O
③用氯化铁溶液和氨水制备氢氧化铁胶体
④除去氯化铜溶液中的氯化铁杂质,可在溶液中加入过量的氧化铜,过滤除杂
⑤在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑥配制Fe(NO3)2溶液时将Fe(NO3)2晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
⑦刻蚀印刷电路板用氯化铁作腐蚀液
⑧用泡沫灭火器灭火
A. ①③⑥⑦⑧ B. ③④⑤⑦⑧
C. ①②④⑤⑧ D. ②③④⑤⑥
难度: 中等查看答案及解析
-
铝、铍( Be)及其化合物具有相似的化学性质。已知BeCl2 +Na2BeO2 +2H2O=2NaCl+2Be(OH)2↓,能完全进行,则下列推断正确的是( )
A. BeCl2是弱电解质,故BeCl2水溶液的导电性弱
B. Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
C. Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
D. 工业上可以用电解熔融BeCl2的方法冶炼金属Be
难度: 中等查看答案及解析
-
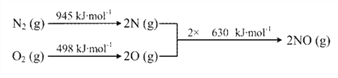
反应2SO2(g) + O2(g)
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )

A. 2SO2(g) + O2(g)
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 足量锌与一定量浓H2SO4反应生成0.5mol气体,反应中转移的电子数为NA
B. 1L 0.1mol/L的CH3COOH溶液中含有H+的数目约为0.1 NA
C. 电解精炼铜(粗铜中含有锌、铁、银等杂质),电路中有2NA个电子通过时,阴极增重64g
D. 常温常压下,1.8 g甲基(-CD3)中含有的电子数为0.9NA
难度: 中等查看答案及解析
-
在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )

A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
难度: 中等查看答案及解析
-
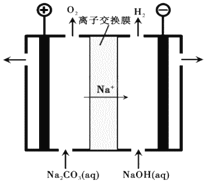
如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-===3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是( )
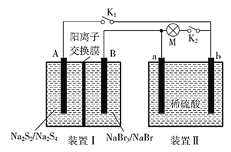
A. 闭合K1、K2时,每有0.1 mol Na+通过离子交换膜,装置II溶液中有0.1mol电子转移
B. 装置Ⅰ放电时的A电极反应式为2Na2S2-2e-===Na2S4+2Na+
C. 断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+===PbSO4+2H2O
D. 断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
难度: 中等查看答案及解析
-
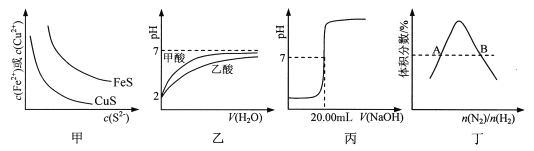
常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
难度: 中等查看答案及解析
-
现有2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
A. 反应后溶液中铁元素可能以Fe2+形式存在
B. 反应后溶液中 c(NO3-)=0.85 mol • L-1
C. 反应后的溶液最多还能溶解1. 4 g Fe
D. 1.12 L气体可能是NO、NO2、H2的混合气体
难度: 中等查看答案及解析
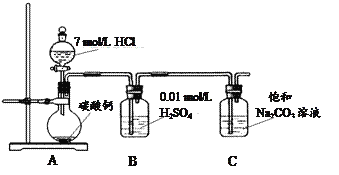
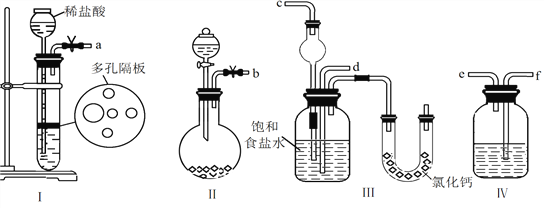 (1)图中所示装置的连接顺序是:a接f;e接________;b接________(填接口编号)。
(1)图中所示装置的连接顺序是:a接f;e接________;b接________(填接口编号)。