-
I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g) 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________;在T℃时,该反应的平衡常数值为_________。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.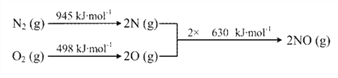
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式________________________
增大压强,NO的转化率______(填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
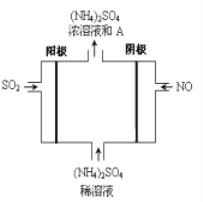
① 阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________
-
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 mol N2和7.5 mol O2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 mol N2和7.5 mol O2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ________;在T ℃时,该反应的平衡常数K = ________。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是________(填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = —180.5 kJ·mol-1
2H2O(l) =2H2(g) + O2(g) △H = +571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
________。
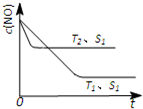
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g) 
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

① 该反应的H________0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线(并作相应标注)。
-
消除汽车尾气是减少城市空气污染的热点研究课题.
(1)汽车内燃机工作时发生的反应N2(g)+O2(g)⇌2NO(g),生成的NO是汽车尾气的主要污染物.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol(不考虑后续反应).则:
①5min内该反应的平均速率ν(NO)=______;在T℃时,该反应的平衡常数K=______.
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是______(填序号).
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的.
已知:2NO(g)=N2(g)+O2(g)△H=-180.5kJ•mol-1
2H2O(l)=2H2(g)+O2(g)△H=+571.6kJ•mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______.
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应2NO(g)+2CO(g)⇌2CO2(g)+N2(g)
中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H______0 (填“>”或“<”).
②若催化剂的表面积S1>S2,在图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
-
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.
①该反应的平衡常数的表达式为K=______.
②T℃时,向容积为2L的密闭容器中充入10mol N2与5mol O2,2min后达到平衡,此时NO的物质的量为2mol,则O2的化学反应速率为______.
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示.(已知:T1<T2)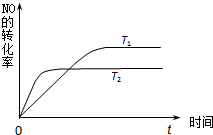
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
②一定温度下,能够说明反应 N2(g)+O2(g)⇌2NO(g) 已达到平衡的是(填序号)______.
a.容器内的压强不发生变化 b.NO生成的速率和NO分解的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内生成4mol NO,同时消耗2mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
则△H2=______.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为______.
-
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.
①该反应的平衡常数的表达式为K=______.
②T℃时,向容积为2L的密闭容器中充入10mol N2与5mol O2,2min后达到平衡,此时NO的物质的量为2mol,则O2的化学反应速率为______.
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示.(已知:T1<T2)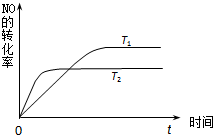
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
②一定温度下,能够说明反应 N2(g)+O2(g)⇌2NO(g) 已达到平衡的是(填序号)______.
a.容器内的压强不发生变化 b.NO生成的速率和NO分解的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内生成4mol NO,同时消耗2mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
则△H2=______.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为______.
-
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.
①该反应的平衡常数的表达式为K=______.
②T℃时,向容积为2L的密闭容器中充入10mol N2与5mol O2,2min后达到平衡,此时NO的物质的量为2mol,则O2的化学反应速率为______.
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示.(已知:T1<T2)
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
②一定温度下,能够说明反应 N2(g)+O2(g)⇌2NO(g) 已达到平衡的是(填序号)______.
a.容器内的压强不发生变化 b.NO生成的速率和NO分解的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内生成4mol NO,同时消耗2mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
则△H2=______.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为______.
-
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为________ ;计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为________ ;计算该条件下的平衡常数(写出计算过程)。
(2)恒温恒容,能说明反应 2NO(g)  N2(g)+O2(g) 达到平衡的是 ________(填代号)。
N2(g)+O2(g) 达到平衡的是 ________(填代号)。
A.NO、N2、O2的浓度之比为2∶1∶1
B.N2的浓度不再发生变化
C.单位时间内消耗2 mol NO,同时消耗1 mol N2
D.容器内气体密度不再发生变化
(3)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) △H = —285.8kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为________ 。
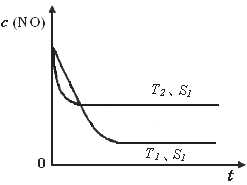
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图是反应:2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
-
汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为________。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图是反应:2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。

-
(12分)近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
⑴汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
K=▲ 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如下图所示。(已知:T1<T2)
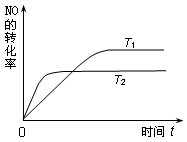
①反应 2NO(g)  N2(g)+O2(g)为(填“吸热”或“放热”)▲ 反应。
N2(g)+O2(g)为(填“吸热”或“放热”)▲ 反应。
②一定温度下,能够说明反应 2NO(g)  N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为▲ 。
-
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
 ⑴汽车内燃机工作时引起反应:N2(g)+O2(g)
⑴汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
K=________▲ 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。
(已知:T1<T2)

①反应 2NO(g)  N2(g)+O2(g)为(填“吸热”或“放热”)________▲反应。
N2(g)+O2(g)为(填“吸热”或“放热”)________▲反应。
②一定温度下,能够说明反应 2NO(g)  N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为▲ 。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。









