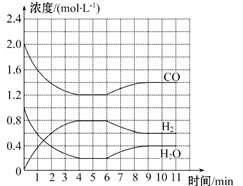
-
室温时,下列混合溶液的pH一定小于7的是
A. pH=3的盐酸和pH=11的氨水等体积混合
B. pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
下列关于反应能量的说法正确的是( )
A. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1 ,则反应物总能量大于生成物总能量
B. 若一定条件下,A=B ΔH<0,说明A物质比B物质稳定
C. 101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 ,则H2的燃烧热为571.6 kJ·mol-1
D. H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量.
难度: 中等查看答案及解析
-
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/c(OH-)
C. c(H+)和c(OH-)的乘积 D. n(OH-)
难度: 中等查看答案及解析
-
下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B. 中和pH、体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C. pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
难度: 中等查看答案及解析
-
已知:H2S与不足量的O2反应时,生成S和H2O。根据以下三个热化学方程式:
2H2S(g)+3O2(g)2SO2(g)+2H2O(l) ΔH1 2H2S(g)+O2(g)2S(s)+2H2O(l) ΔH2
2H2S(g)+O2(g)2S(s)+2H2O(g) ΔH3
判断ΔH1、ΔH2、ΔH3三者大小关系正确的是
A. ΔH3>ΔH2>ΔH1 B. ΔH1>ΔH3>ΔH2 C. ΔH1>ΔH2>ΔH3 D. ΔH2>ΔH1>ΔH3
难度: 简单查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是
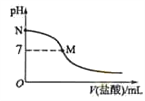
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
难度: 困难查看答案及解析
-
以0.100 0 mol·L-1 NaOH溶液滴定c mol·L-1某弱酸HA溶液,其滴定曲线如图所示。下列说法正确的是
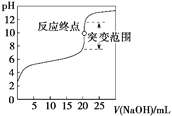
A. 可用甲基橙作滴定指示剂(已知甲基橙的变色范围为3.1~4.4,pH<3.1时溶液为红色,pH>4.4时溶液为黄色)
B. 指示剂指示的滴定终点就是反应终点
C. 突变范围的大小与酸的强弱及酸的浓度有关
D. 滴定时氢氧化钠溶液盛放在带活塞的滴定管中
难度: 中等查看答案及解析
-
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离平衡常数约为1×10-7
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的浓度乘积是一个常数
B. 已知AgCl的Ksp=1.8×10-10,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+与Cl-浓度的乘积等于1.8×10-10mol2·L-2
C. Ksp数值越大的难溶电解质在水中的溶解能力越强
D. 难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响
难度: 中等查看答案及解析
-
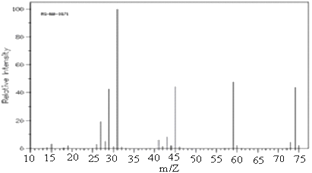
有机物R的质谱图如右图,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有两个侧链,其中一个是-C2H5,符合此条件的烃R的结构有
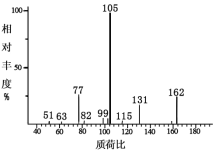
A.6种 B.9种
C.12种 D.15种
难度: 困难查看答案及解析
-
已知苯(
)分子有一类氢原子,其中二氯代物有3种,萘(
)分子有两类氢原子,其中二氯代物有10种,蒽(
)分子有三类氢原子,其中二氯代物有
A. 13种 B. 15种 C. 18种 D. 20种
难度: 困难查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是

A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.电池的总反应可表示为:VO2++V2++2H+
VO2++V3++H2O
难度: 中等查看答案及解析
-
已知乙烯和丙烯的混合物的质量为m g,NA代表阿伏加德罗常数,则该混合物
A. 所含共用电子对数目为(
+1)NA B. 所含碳氢键数目为
NA
C. 燃烧时消耗的O2一定是
L D. 所含原子总数为
NA
难度: 中等查看答案及解析
-
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A. 电池内部H+由正极向负极移动
B. 另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C. 乙醇在正极发生反应,电子经过外电路流向负极
D. 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 中等查看答案及解析
-
下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析