-
《淮南万毕术》中有“曾青得铁,则化为铜,外化而内不化”,下列说法中正确的是
A. “外化”时化学能转化为热能
B. “化为铜”表明铁转化为铜
C. “内不化”是因为内部的铁活泼性较差
D. 反应中溶液由蓝色转化为黄色
难度: 简单查看答案及解析
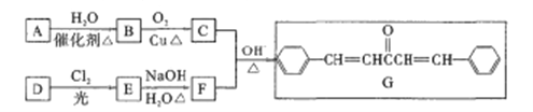
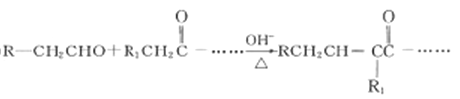
-
诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
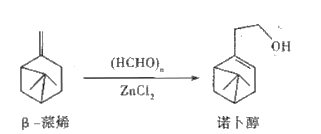
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
难度: 中等查看答案及解析
-
下列实验的叙述中有错误的是
选项
实验操作
目的或结论
A
向2mL滴有2滴KSCN溶液的FeI2溶液中加入几滴氯水
确定Fe2+、I-还原性的相对强弱
B
将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至170℃,将从瓶内逸出的物质通入到酸性KMnO4溶液中
检验有无乙烯生成
C
将含有CO的CO2缓慢通过灼热的CuO
除去CO
D
用一定浓度的NaOH滴定一定体积、浓度的草酸(H2C2O4、弱酸)溶液(用酚酞作指示剂)
确定草酸是二元酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W是四种原子序数依次增大的短周期主族元素,X、Y之间可形成Q、M两种常见的无机化合物,其中Q是重要的能源物质,W原子的最外层电子数是Z原子最外层电子数的2倍,W的单质广泛用于光伏发电,下列说法中正确的是
A. 常见氢化物的稳定性:X<W
B. 原子半径:W>Z>X>Y
C. 工业上用Q还原Z的氧化物得到Z单质
D. Z的单质能在M中剧烈燃烧
难度: 中等查看答案及解析
-
已知25℃时,RSO4(s)+CO32-(aq)
RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A. 向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B. 将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C. 25℃时,RSO4的Ksp约为4.9×10-5
D. 相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
难度: 中等查看答案及解析
-
K2S2O8具有强氧化性(S2O82-中含有过氧根),在石油行业中有重要用途,工业上可利用电解法制备它,工作原理如图(电极材料是石墨)所示,下列说法中错误的是
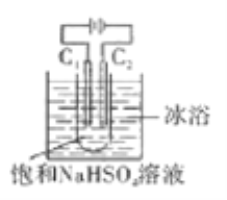
A. C1电极上的电极反应式为:2SO42--2e-=S2O82-
B. 通电后Na+移向C2电极
C. 反应一段时间后,溶液的pH减小
D. 电解过程中,两电极上参与反应的离子的物质的量相等
难度: 中等查看答案及解析
-
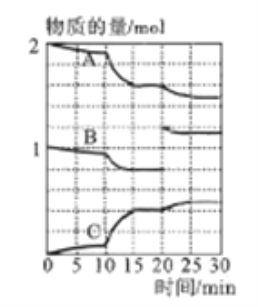
已知H2X的溶液中只有一种分子,但存在HX-、X2-等四种离子。常温下向20mL0.2mol/L的H2X溶液中滴加0.2mol/L的NaOH溶液,滴加过程中溶液pH与滴入的NaOH溶液体积关系如图所示,下列说法中正确的是
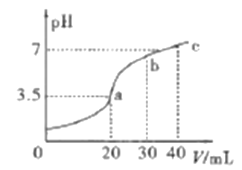
A. X2-+H2O
HX-+OH-的平衡常数Kb≈1×10-8
B. a点的溶液中:c(X2-)+c(HX-)<0.1mol/L
C. c点时溶液中:c(Na+)>c(X2-)>c(HX-)>c(OH-)>c(H+)
D. b点时n(Na+)>n(X2-)=n(HX-)
难度: 困难查看答案及解析