-
设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A. 因为冰醋酸是弱电解质,所以60g冰醋酸中所含离子总数大于0小于2NA
B. 4gNaOH固体中的离子总数为0.2NA
C. 22.4LO2中所含电子数为16NA
D. 1molNa与O2反应生成Na2O2,共转移2mol电子
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
难度: 中等查看答案及解析
-
下列有关说法,正确的是 ( )
A. 氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
B. 化学反应中能量变化的本质原因是反应物的总能量和生成物的总能量不同
C. 不需要加热就能发生的反应是放热反应
D. Al(OH)3有弱碱性,可用于中和胃酸
难度: 中等查看答案及解析
-
灰锡结构松散,不能用于制造器皿;而白锡结构坚固,可以制造器皿。己知0℃、101 kPa时Sn(白,s)=Sn(灰,s)△H= -2180.9 J·mol-1,△S=- 6.61 J·mol-1·K-1。假设△H和△S不随温度的改变而改变,现把白锡制造的器皿放在室温下存放,它会不会变成灰锡而不能继续使用 ( )
A. 会变 B. 不会变 C. 不能确定 D. 升高温度才会变
难度: 中等查看答案及解析
-
已知CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1; HCl(aq)与NaOH(aq)反应的△H =-55.6 kJ·mol-1。则CH3COONa和HC1在水溶液中反应的△H等于 ( )
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
难度: 中等查看答案及解析
-
某化学反应A2(g)+2B2(g)
2AB2(g)的能量变化如图所示,下列叙述中正确的是( )
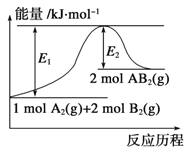
A. 该反应进行时一定需要加热
B. 该反应的△H=-(E1-E2) kJ/mol
C. 向某容器中加入lmolA2气体和3mol B2气体,达到平衡时吸收(El-E2) kJ的热量
D. 该反应中,反应物的键能总和大于生成物的键能总和
难度: 中等查看答案及解析
-
能与氨水反应的弱电解质是 ( )
A. 醋酸溶液 B. 硫化氢 C. 二氧化硫 D. 硫酸铜
难度: 中等查看答案及解析
-
室温下将l0mL c(H+)=0.00lmol/L的醋酸溶液加水稀释10倍后,下列说法正确的是( )
A. 醋酸的电离程度增大,c(H+)亦增大
B. 溶液中
不变
C. 溶液中导电粒子的数目增多
D. 再加入l0mL c(OH-)=0.00lmol/L的NaOH溶液,混合液呈中性
难度: 困难查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得C的浓度为0.50mol/L。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90mol/L。下列有关判断正确的是 ( )
A. C的体积分数增大了 B. A的转化率降低了
C. 平衡向正反应方向移动 D. x+y>z
难度: 困难查看答案及解析
-
现将浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)。下列叙述错误的是 ( )
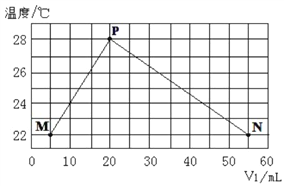
A. 实验的环境温度低于22℃ B. 混合溶液的导电能力:M>N
C. P点混合溶液呈中性 D. 若将H2SO4改为CH3COOH,P点温度低于28℃
难度: 困难查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同 ( )
A. 保持体积和温度不变,充入一定量的氧气 B. 保持温度不变,缩小容器的体积
C. 保持体积不变,升高温度 D. 保持体积和温度不变,加入BaO2
难度: 困难查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX和3molY发生反应:X(s)+mY(g)
3Z(g),平衡时,Y、Z的体积分数分别为60%、40%,在此平衡体系中加入2mol Z(g),再次达到平衡后,Y、Z的体积分数不变。下列叙述不正确的是 ( )
A. 从向平衡体系中加入2mol Z(g)到重新达到平衡始终存在v(逆)>v(正)
B. 两次平衡的平衡常数相同
C. 第二次平衡时,Z的浓度为2mol·L-1
D. m=3
难度: 困难查看答案及解析
-
为了探索外界条件对反应X(g)+Y(?)
cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
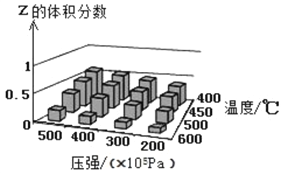
A. △H>0 c<2
B. 400℃、4×l07Pa下,该反应达平衡时X的体积分数是25%
C. Y可以是气体也可以是非气体
D. 反应物的转化率随压强增大而减小
难度: 中等查看答案及解析
-
下列表述中正确的是
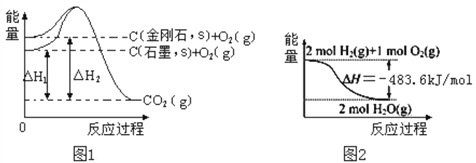
A. l0lkPa时,1molC和3molC的燃烧热相等
B. 由图1可知金刚石比石墨稳定
C. 由图2可知H2的燃烧热数值大于483.6kJ/mol
D. 汽油燃烧时将全部的化学能转化为热能
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 弱电解质溶液的导电能力一定比强电解质溶液弱
B. 将等体积、等浓度的NaOH溶液和氨水各稀释一倍后,两者中和等浓度盐酸的能力氨水强于NaOH溶液
C. 物质的量浓度相同的磷酸钠溶液和磷酸溶液所含PO43-浓度也相同
D. 如果盐酸中c(H+)是醋酸溶液中c(H+)的2倍,则c (HCl) <2c (CH3COOH)
难度: 困难查看答案及解析
-
橡皮筋在拉伸和收缩状态时结构如图。在其拉伸过程中有放热现象。25℃、101 kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是()
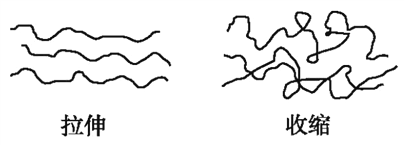
A. CaCO3=CaO+CO2↑ B. NaOH的溶解
C. 2H2+O2=2H2O D. Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
难度: 中等查看答案及解析