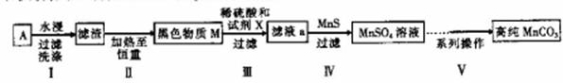
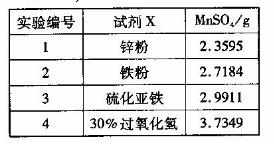
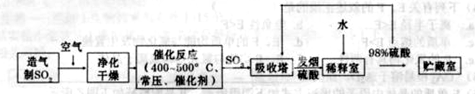
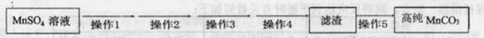-
下列说法正确的是( )
A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
B.Si、P、S、Cl 相应的最高价氧化物对应水化物的酸性依次增强
C.工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质
D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行
难度: 中等查看答案及解析
-
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A.在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B。两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C.常温常压下,agC2H4和C3H6的混合气体中所含共用电子对数目为3a/14·NA
D.6.0g金刚石中含有的共价键数为2 NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度
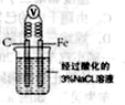
B.如图,一段时间后给烧杯内地溶液中加入黄色的
溶液,可看到Fe电极附近有蓝色沉淀生成
C.用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
D.用加热的方式可提取
固体中混有的少量的碘
难度: 中等查看答案及解析
-
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
②
时,亚磷酸(
,二元酸)的
,
;
草酸(
)的
,
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.
C.
D.
难度: 中等查看答案及解析
-
X 、Y、 Z、 W是原子序数依次增大的四种短周期元素,A、B、C、D、F有其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(
)。它们满足如图转化关系,则下列说法正确的是( )
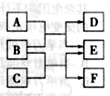
A.原子半径W>Z>Y>X
B.化合物F中含有共价键和离子键
C.在B和C的反应中,氧化剂是B,还原剂是C
D.Z元素的最高正价为+6
难度: 中等查看答案及解析
-
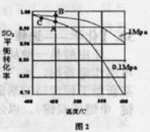
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是( )
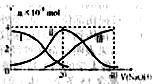
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH减小
难度: 中等查看答案及解析