-
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 
| 
| |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.氮气的转化率:
b.氮气的转化率: c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
-
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
-
(6分)随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
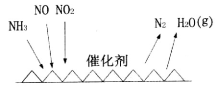
①SCR技术中的氧化剂为____________
②当NO2与NO的物质的量之比为1:l时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______。当有3 mol电子发生转移时,则参与反应的NO的物质的量为________。
(2)电镀废水中常含有毒的NaCN、HCN等。NaCN水溶液显碱性的原因是_____________(用离子方程式表示);HCN的Ka=6.17×10-10,用NaOH溶液调节含CN-的废水至pH=9,此时废水中c(CN-)_______c(HCN)(填“>”、“<”或“=”)。
(3)室温下有如下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的电离平衡常数K=1.75×10-5;碳酸的电离平衡常数K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4)=5.0×10-9;Ksp (CaCO3)=2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是___________;
②向0.6 mol·L-1的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq)+ CaC2O4 (s) CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
-
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时, =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
-
氨是化肥工业和基本有机化工的主要原料,合成氨工业因此成为基本无机化工之一。回答下列问题:
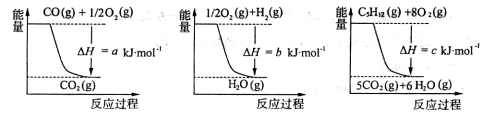
(1)如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法 获得氢气:
C5H12(g)+5H2O(g)  5CO(g)+11H2(g)
5CO(g)+11H2(g)
已知几个反应的能量变化如下图所示,则上述反应的△H=____________kJ·mol-1
(2)合成氨的反应原理为:
3H2(g)+N2(g) 2NH3(g)
2NH3(g)
现有甲、乙、丙3个固定容积为2 L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示:
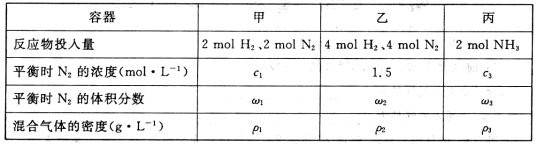
①下列描述不能说明该反应已达到平衡状态的是_____________.(填序号);
a.容器内混合气体的密度保持不变
b.3v正(N2)==v逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20 min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=___________mol·L-1·min-1,该温度下,反应的平衡常数K=___________L2·mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是________(填序号)。
a.cl>c3 b.wl<w2 c. >
> >
>
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是________。
-
氨是化肥工业和基本有机化工的主要原料,合成氨工业因此成为基本无机化工之一。回答下列问题:
(1)如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法获得氢气:C5H12(g)+5H2O(g) 5CO(g)+11H2(g)
5CO(g)+11H2(g)
已知几个反应的能量变化如下图所示,则上述反应的△H=__________kJ·mol-1
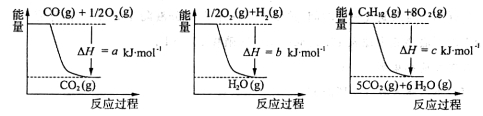
(2)合成氨的反应原理为:3H2(g)+N2(g) 2NH3(g)
2NH3(g)
现有甲、乙、丙3个固定容积为2 L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| 平衡时N2的体积分数 | w1 | W2 | W3 |
| 混合气体的密度(g•L-1) | ρ1 | ρ2 | ρ3 |
①下列描述不能说明该反应已达到平衡状态的是_________.(填序号);
a.容器内混合气体的密度保持不变
b.3v正(N2)==v逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20 min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=_________mol·L-1·min-1,该温度下,反应的平衡常数K=__________L2·mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是____________(填序号)。
a.cl>c3 b.wl<w2 c. >
> >
>
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是__________。
-
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
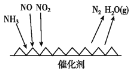
①由图可知SCR技术中的氧化剂为____。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式:_______。
(2)ClO2气体是一种常用的消毒剂,现在被广泛用于饮用水消毒。自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝
Ⅱ.加入一定量的Na2S2O3溶液(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1.3。
已知:ClO2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为Cl-。请回答下列问题:
①确定操作Ⅱ完全反应的现象为________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式为______。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____mg/L。
-
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:
①如图可知SCR技术中的氧化剂为
②用Fe做催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式
(2)工业废水中常含有一定量的Cr2O72﹣,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法.该法用Fe做电极电解含Cr2O72﹣的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀.
①反应中lmol Cr2O72﹣完全生成Cr(OH)3沉淀,外电路通过电子的物质的量 mol;
②常温下,Cr(OH)3的溶度积Ksp=10﹣32,当Cr3+浓度小于10﹣5mol•L一1时,可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后 (填“能”或“否”)直接排放.
(3)C1O2气体是一种常用的消毒剂,现在被广泛的用于饮用水进行消毒.自来水厂用ClO2处理后的水中,要求C1O2的浓度在0.1﹣0.8mg•L﹣1之间.碘量法可以检测水中C1O2的浓度,步骤如下:
I.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加人一定量的碘化钾,并加人淀粉溶液,溶液变蓝;
Ⅱ.加人一定量的Na2S203溶液(已知:2S2O32﹣+I2═S4O62﹣+2I﹣);
Ⅲ.加硫酸调节水样pH至1.3.
已知:本题中C1O2在中性条件下还原产物为ClO2﹣,在酸性条件下还原产物为C1﹣.
请回答下列问题:
①确定操作II完全反应的现象
②在操作III过程中,溶液又呈蓝色,反应的离子方程式
③若水样的体积为1.0L,在操作II时消耗了1.0×10﹣3mol•L﹣1的Na2S2O3溶液10mL,则水样中ClO2的浓度是 mg•L﹣1.
-
目前“低碳减排”备受关注, 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。
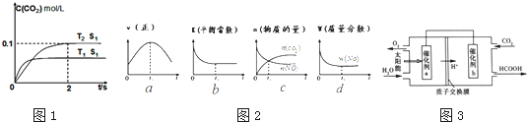
(1)汽车尾气净化的主要原理为 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度
随温度 、催化剂表面积
、催化剂表面积 和时间
和时间 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的 ______
______ 填“
填“ ”或“
”或“ ”
” 。
。
②在 温度下,
温度下, 内的平均反应速率
内的平均反应速率 ______
______ 。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积 ,在答题卡相应图中画出
,在答题卡相应图中画出 在
在 、
、 条件下达到平衡过程中的变化曲线_____。
条件下达到平衡过程中的变化曲线_____。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到 时刻达到平衡状态的是______
时刻达到平衡状态的是______ 填代号
填代号 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如: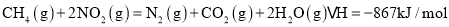

写出 催化还原
催化还原 生成
生成 、
、 和
和 的热化学方程式:______。
的热化学方程式:______。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图。催化剂b表面发生的电极反应为______
的原理示意图。催化剂b表面发生的电极反应为______
③常温下 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数 ______
______ 填写最终计算结果
填写最终计算结果 。
。
-
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用 处理
处理 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
①该反应历程中正反应的最大活化能为________ 。
。
②合成氨反应的热化学方程式为_________________。
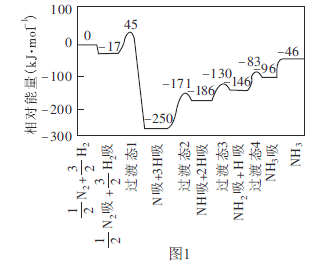
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的 ________N点的
________N点的 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② ℃时,将
℃时,将
 和
和
 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________ (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
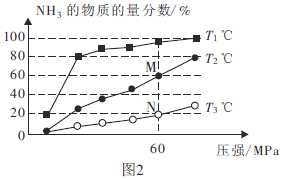
(3)①用次氯酸钠除去氨氮(以 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
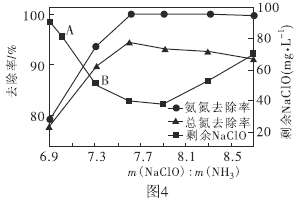
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随 的变化情况如图4所示。当
的变化情况如图4所示。当 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将 转化为
转化为 ,部分装置如图5所示。
,部分装置如图5所示。
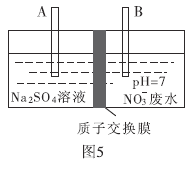
①B电极的电极反应式是________.
②常温下,除去10L废水中的
 后,最终废水的
后,最终废水的 ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
d.混合气体的密度保持不变
=
b.氮气的转化率:
c.
d.
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。