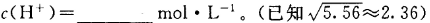-
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
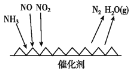
①由图可知SCR技术中的氧化剂为____。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式:_______。
(2)ClO2气体是一种常用的消毒剂,现在被广泛用于饮用水消毒。自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝
Ⅱ.加入一定量的Na2S2O3溶液(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1.3。
已知:ClO2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为Cl-。请回答下列问题:
①确定操作Ⅱ完全反应的现象为________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式为______。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____mg/L。
-
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:
①如图可知SCR技术中的氧化剂为
②用Fe做催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式
(2)工业废水中常含有一定量的Cr2O72﹣,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法.该法用Fe做电极电解含Cr2O72﹣的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀.
①反应中lmol Cr2O72﹣完全生成Cr(OH)3沉淀,外电路通过电子的物质的量 mol;
②常温下,Cr(OH)3的溶度积Ksp=10﹣32,当Cr3+浓度小于10﹣5mol•L一1时,可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后 (填“能”或“否”)直接排放.
(3)C1O2气体是一种常用的消毒剂,现在被广泛的用于饮用水进行消毒.自来水厂用ClO2处理后的水中,要求C1O2的浓度在0.1﹣0.8mg•L﹣1之间.碘量法可以检测水中C1O2的浓度,步骤如下:
I.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加人一定量的碘化钾,并加人淀粉溶液,溶液变蓝;
Ⅱ.加人一定量的Na2S203溶液(已知:2S2O32﹣+I2═S4O62﹣+2I﹣);
Ⅲ.加硫酸调节水样pH至1.3.
已知:本题中C1O2在中性条件下还原产物为ClO2﹣,在酸性条件下还原产物为C1﹣.
请回答下列问题:
①确定操作II完全反应的现象
②在操作III过程中,溶液又呈蓝色,反应的离子方程式
③若水样的体积为1.0L,在操作II时消耗了1.0×10﹣3mol•L﹣1的Na2S2O3溶液10mL,则水样中ClO2的浓度是 mg•L﹣1.
-
(17分)随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
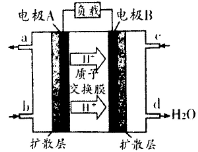
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积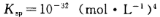 ,当Cr3+浓度小于10
,当Cr3+浓度小于10 mol
mol 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中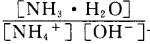 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3•H2O的电离平衡常数
时,NH3•H2O的电离平衡常数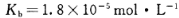 ,该温度下,1mol
,该温度下,1mol 的NH4Cl溶液中
的NH4Cl溶液中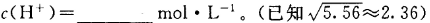
-
(6分)随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
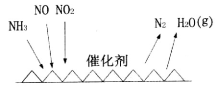
①SCR技术中的氧化剂为____________
②当NO2与NO的物质的量之比为1:l时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______。当有3 mol电子发生转移时,则参与反应的NO的物质的量为________。
(2)电镀废水中常含有毒的NaCN、HCN等。NaCN水溶液显碱性的原因是_____________(用离子方程式表示);HCN的Ka=6.17×10-10,用NaOH溶液调节含CN-的废水至pH=9,此时废水中c(CN-)_______c(HCN)(填“>”、“<”或“=”)。
(3)室温下有如下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的电离平衡常数K=1.75×10-5;碳酸的电离平衡常数K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4)=5.0×10-9;Ksp (CaCO3)=2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是___________;
②向0.6 mol·L-1的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq)+ CaC2O4 (s) CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
-
汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
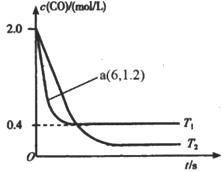
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处 =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:
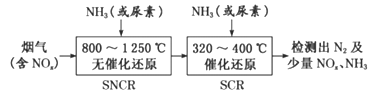
①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:
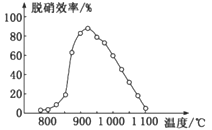
SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
-
近年来,我国机动车保有量持续增长,汽车尾气排放已成为城市的主要污染源,汽车尾气催化净化成为及其重要的环保产业。回答下列问题:
(1)用活性炭还原法可以处理汽车尾气中氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 
| 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①第一次达平衡时,NO的转化率为_____________ ,T1℃时,该反应的平衡常数K=_______________。
②30min后只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________;
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=________。
④若升高温度为T2℃,该反应是平衡常数K减小,原因是_______________。
(2)在汽车排气管加装催化转换器,可有效降低污染物的浓度。已知,催化转换器的效率计算:
ηi=  ×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
| 温度/℃ | 流量/(m3·h-1) | CxHy/(106ppm) | CO/% | NOx/(106ppm) |
| 入口 | 100 | 0.2 | 139 | 2.66 | 21 |
| 出口 | 31 | 0 | 0 |
①在上述条件下,η(CO)、η(NOx)均达100%,η(CxHy)=_____________。
②两种不同的催化剂JFG和HPA-8在不同温度、流量下CxHy的去除率如图所示:
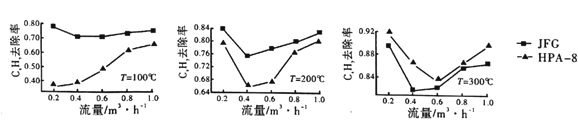
比较两种催化剂在不同温度下对CxHy的转化效率,由此可得出的结论是____________。
-
燃煤和汽车尾气是造成空气污染的原因之一,雾疆天气肆虐给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
己知:
CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
2NO2(g)  N2O4(g) △H=-56.9kJ·mol-1
N2O4(g) △H=-56.9kJ·mol-1
H2O(g)=H2O(l) △H=-44.0kJ·mol-1
①写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式________________。
②反应CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(l)在恒温恒容容器中达到平衡,下列叙述不能作为判断该反应达到平衡状态标志的是___________。
N2(g)+CO2(g)+2H2O(l)在恒温恒容容器中达到平衡,下列叙述不能作为判断该反应达到平衡状态标志的是___________。
A.容器中的压强不变 B.混合气体的密度不变
C.2v正(NO2)= v 逆(N2) D.c(CH4)= c(N2)
(2)CO、CO2 是火力发电厂及汽车尾气的主要成分,为减少对环境造成的影响,采用以下方法将其资源化利用。
①以CO 为电极燃料,以熔融K2CO3为电解质,和O2组成燃料电池。请写出该电池的负极电极反应式_____________________。
②在铝矾土作催化剂、773K条件下,3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,该反应可用于从烟道气中回收硫,写出该反应的化学方程式_______________。
③在汽车的排气管上增加一个补燃器,并不断补充O2使其浓度保持为4.0×10-4mol·L-1,发生反应2CO(g)+O2(g)  2CO2(g)。某温度下测得汽车尾气中CO、CO2 气体的浓度分别为2.0×10-6 mol·L-1、4.0×10-4 mol·L-1,则该条件下反应的平衡常数K=___________。
2CO2(g)。某温度下测得汽车尾气中CO、CO2 气体的浓度分别为2.0×10-6 mol·L-1、4.0×10-4 mol·L-1,则该条件下反应的平衡常数K=___________。
-
下列说法正确的是
A.通常用石油的年产量来衡量一个国家的石油化学工业发展水平
B.酸雨的形成主要是汽车排出大量尾气
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.二氧化碳在我国重点城市近年来已发布的“空气质量日报”中不列入首要污染物
-
“雾疆”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质 催化还原尾气中的NO气体,该过程的化学方程式为________。
催化还原尾气中的NO气体,该过程的化学方程式为________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在 的气氛下燃烧,能够降低煤炭燃烧时NO的排放,主要反应为
的气氛下燃烧,能够降低煤炭燃烧时NO的排放,主要反应为 。
。
已知:①

②

③

则反应 的
的 ________。
________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的 溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
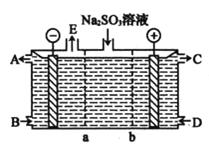
① 表示________
表示________ 填“阴离子”或“阳离子”
填“阴离子”或“阳离子” 交换膜。
交换膜。 分别代表生产中的原料或产品,其中C为硫酸溶液,则A表示________,E表示________。
分别代表生产中的原料或产品,其中C为硫酸溶液,则A表示________,E表示________。
②阳极的电极反应式为________。
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中 发生催化氧化的反应为
发生催化氧化的反应为 。若在
。若在 、
、 条件下,往一恒容密闭容器中通入
条件下,往一恒容密闭容器中通入 和
和 的混合气体
的混合气体 :
: :
: ,测得容器内总压强与反应时间的关系如图所示。
,测得容器内总压强与反应时间的关系如图所示。
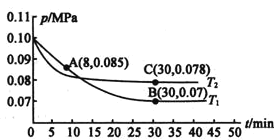
①图中A点时, 的转化率为________。
的转化率为________。
②在其他条件不变的情况下,测得 时压强的变化曲线如图2所示,则C点的正反应速率
时压强的变化曲线如图2所示,则C点的正反应速率 正
正 与A点的逆反应速率
与A点的逆反应速率 逆
逆 的大小关系为
的大小关系为 正
正 ________
________ 填“
填“ ”“
”“ ”或“
”或“ ”
” 逆
逆 。
。
③图中B点的压强平衡常数 ________
________ 用平衡分压代表平衡浓度计算,分压
用平衡分压代表平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 。
。
-
环境问题已经成为世界上越来越重要的议题,其中大气污染主要有硫的氧化物和氮的氧化物,工业生产是其原因之一,同时工业上通常也用下列方法来治理污染。
(1)烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)⇌CO2(g)+CaO(s) △H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)⇌CaSO3(s) △H=﹣402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)⇌2[CaSO4•2H2O](s) △H=﹣234.2kJ/mol
试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式 .
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气体3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
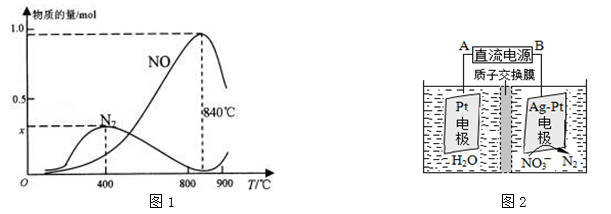
(3)氨催化氧化是硝酸工业的基础,反应原理为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)实际生产中,还会发生此反应:4NH3+3O2⇌N2+6H2O,在1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中,有关温度与各物质的量关系如图1所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x= 。
②NH3生成N2的反应属于 (填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是 。
(4)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。



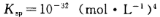 ,当Cr3+浓度小于10
,当Cr3+浓度小于10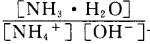 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25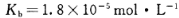 ,该温度下,1mol
,该温度下,1mol