-
化学与生产、生活、科技等密切相关,下列说法不正确的是( )
A. 加大清洁能源的开发利用,提高资源的利用率
B. 研发使用高效催化剂,可提高反应中原料的转化率
C. 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物
D. 用沼气、太阳能、风能等新型能源代替化石燃料
难度: 中等查看答案及解析
-
下列指定化学用语正确的是( )
A. NaHCO3 水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4 = Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
难度: 简单查看答案及解析
-
下列既是放热反应,又是离子反应的是( )
A. 碳酸钙高温时的分解反应 B. 氢氧化钠和稀硫酸中和
C. 氯化铵与氢氧化钡晶体的反应 D. 铝和氧化铁在高温下的反应
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. Kw/c(OH-)=10-l2 mol•L-1 的溶液中:Na+、K+、SO32-、Cl-
B. 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3- 、SO42-
C. 由水电离出的c(H+)=1.0×10-l3 mol•L-1 的溶液中:Na+、CO32-、K+、Cl-
D. 使KSCN显红色的溶液中:NH4+、K+、Cl-、AlO2-
难度: 中等查看答案及解析
-
下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
A. AgCl沉淀生成和溶解不断进行,但速率相等
B. AgCl难溶于水,溶液中没有Ag+和Cl-
C. 升高温度,AgCl的溶解度减小
D. 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
难度: 中等查看答案及解析
-
以下反应均可生成O2,下列有关说法正确的是( )
①二氧化碳分解生成氧气:2CO2(g)=2CO(g)+O2(g) ΔH1=+566 kJ·mol-1
②过氧化氢分解生成氧气:2H2O2(l)=2H2O(l)+O2(g);ΔH2=-196.4 kJ·mol-1
③光照条件下,催化分解水蒸气生成氧气:2H2O(g)=2H2(g)+O2(g);ΔH3=+483.6 kJ/mol
A. 反应①为放热反应
B. 反应②使用催化剂,能降低该反应的活化能,但不能改变ΔH2
C. 反应③将化学能转化为光能
D. 反应CO(g)+H2O(g) = CO2(g)+H2(g);ΔH=-82.4 kJ·mol-1
难度: 中等查看答案及解析
-
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2 。下列关于该电池的说法错误的是( )

A. 食盐水作为电解质溶液
B. 电池工作时镁片作为正极逐渐被消耗
C. 电池工作时实现了化学能向电能的转化
D. 活性炭电极上的反应为O2 + 2H2O + 4e- = 4OH -
难度: 中等查看答案及解析
-
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( )
A. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小
D. 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
一定温度下,在密闭容器中发生反应:2HI(g)= H2(g)+I2(g),能说明该反应达到平衡状态的标志是
A. 单位时间内消耗1molH2,同时生成2mol HI
B. 每断裂2molH-I键,同时有1mol H—H键断裂
C. 容器中压强不再变化
D. 容器中混合气体的密度不再变化
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 对于平衡体系:2NO2(g)
N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
B. 某研究性学习小组为研究酸雨的成分,收集一部分酸雨测其pH,结果一天后再测,发现雨水的pH 减小
C. 光照新制氯水时,溶液的pH 逐渐减小
D. 合成氨工厂通常采用20MPa~50MPa 的高压,以提高原料的利用率
难度: 中等查看答案及解析
-
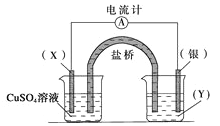
右图所示原电池的总反应为:Cu(s)+2Ag+(aq)
Cu2+(aq)+2Ag(s),下列叙述正确的是( )

A. 电子从银电极经导线流向铜电极
B. 工作一段时间后,右烧杯中溶液的pH变小
C. 电池工作时,Cu2+向铜电极移动
D. 将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转
难度: 中等查看答案及解析
-
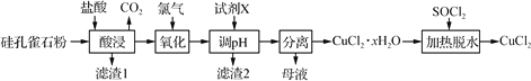
研究发现,腐蚀严重的青钢器表面大都存在CuC1。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述不正确的是( )
A. 降低了反应的活化能 B. 增大了反应的速率
C. 没有改变化学反应过程 D. 没有改变反应的平衡常数
难度: 中等查看答案及解析
-
不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃﹣700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32﹣﹣2e﹣═H2O+CO2,则下列推断正确的是( )
A. 正极反应为:O2+2H2O+4e﹣═4OH﹣
B. 放电时CO32﹣向负极移动
C. 电池供应1mol水蒸气,转移电子4mol
D. 放电时正极发生氧化反应
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. S(g) +O2(g)=SO2 (g)可用该反应的ΔH表示燃烧热
B. 测定中和热的实验中,一组完整的实验数据至少需要测量3次
C. 通过直接蒸发MgCl2溶液的方法获取无水氯化镁固体
D. 除去CuC12溶液中的Fe3+离子,选用氢氧化钠溶液作沉淀剂
难度: 中等查看答案及解析
-
已知醋酸在水溶液中建立如下电离平衡: CH3COOH
H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是( )
A. 通氯化氢气体 B. 加入少量醋酸钾固体
C. 加入少量氢氧化钠固体 D. 通入少量冰醋酸
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
B. 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7
C. 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH)
D. 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
难度: 中等查看答案及解析
-
常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。下列说法不正确的是

A. 图中表示醋酸溶液中pH变化曲线的是B
B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,则m1<m2
C. pH=2时盐酸和醋酸的物质的量前者小
D. pH=4时两溶液c(Zn2+)相等
难度: 中等查看答案及解析
-
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
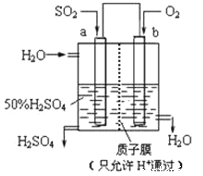
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 铅蓄电池工作时,电解质溶液H2SO4的浓度不变
B. 加水稀释0.1 mol·L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小
C. 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
D. 标准状况下,2.24L CCl4含有的共价键数为0.4×6.02×1023个
难度: 中等查看答案及解析
-
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO
没有毒性,CO
有毒性
C. BaSO4的密度大
D. 胃酸能与CO
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
难度: 中等查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是
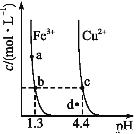
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
难度: 困难查看答案及解析