-
“低碳经济,节能减排”是2010年上海世博会的主题,下列做法符合这一思想的是( )
A.加大开发水能、风能、核能、太阳能、生物能等新能源
B.研究将二氧化碳深埋海底的技术,以减少大气中二氧化碳的含量
C.大力开发西部的油气资源以满足经济发展的需要
D.减少我国的煤炭开采,加大从澳大利亚等国进口煤炭难度: 中等查看答案及解析
-
下列物质中属于电解质的是( )
A.氯气
B.硫酸钠
C.乙醇
D.二氧化硫难度: 中等查看答案及解析
-
下列条件中可以促进水的电离的是( )
A.升高温度
B.加入少量固体氢氧化钾
C.加入少量固体氯化钠
D.滴加少量浓盐酸难度: 中等查看答案及解析
-
蒸干并灼烧下列物质的水溶液,仍能得到该物质的是( )
A.氯化铝
B.碳酸氢钠
C.硫酸钠
D.高锰酸钾难度: 中等查看答案及解析
-
钢铁在潮湿的环境中会形成原电池而被腐蚀,下列说法正确的是( )
A.原电池的负极反应为:Fe-3e-→Fe3+
B.发生吸氧腐蚀的总反应为:Fe+2H+═Fe2++H2↑
C.钢铁设备上连接铜块可以防止腐蚀
D.在南方沿海地区,钢铁更容易被腐蚀难度: 中等查看答案及解析
-
下列条件中不可以加快2H2O2(aq)═2H2O(l)+O2(g)的化学反应速率的是( )
A.增大H2O2的浓度
B.加入MnO2作催化剂
C.升高反应温度
D.增大压强难度: 中等查看答案及解析
-
在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是( )
A.Na+、Cu2+、Cl-、SO42-
B.Ba2+、K+、OH-、NO3-
C.K+、Ca2+、NH4+、CO32-
D.H+、Ca2+、Cl-、HCO3-难度: 中等查看答案及解析
-
已知反应2CO(g)═2C(s)+O2(g)的△H>0,△S<0,设△H和△S不随温度而变化,下列说法中正确的是( )
A.低温下能自发变化
B.高温下能自发变化
C.任何温度下都能自发进行
D.任何温度下都不能自发进行难度: 中等查看答案及解析
-
常见的铅蓄电池的电极材料为PbO2和Pb,电解液为30%的稀硫酸溶液,电池放电的总反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,则下列说法正确的是( )
A.PbO2为电池的负极
B.放电时电子由正极流向负极
C.放电时正极发生氧化反应
D.放电时电解液的pH值逐渐增大难度: 中等查看答案及解析
-
常温下,将pH=13的NaOH溶液与pH=2的HCl溶液按1:9的体积比混合,设混合溶液的总体积为二者相加,则所得混合液的pH值是( )
A.11
B.15
C.12
D.7.5难度: 中等查看答案及解析
-
如下操作能达到实验目的是( )
A.
电解精炼铜
B.
量取9.00mL的稀盐酸溶液
C.
在铁上镀铜
D.
测定溶液的pH值难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.常温常压下,11.2 L氯气与足量钠充分反应转移电子数为NA
B.常温常压下,17g氨气中含氢原子数为3NA
C.标准状况下电解水,阴极生成11.2L气体,则电路中通过的电子数为2NA
D.1L 1mol•L-1的Na2CO3溶液中含有NA个CO32-难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.鸡蛋壳在醋酸中溶【解析】
CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O
B.Na2CO3溶液使酚酞变红:CO32-+H2O⇌HCO3-+OH-
C.向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2++SO42-═BaSO4↓
D.向NaHCO3溶液中加入稀盐酸溶液:CO32-+2H+═H2O+CO2↑难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
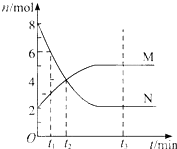
A.反应的化学方程式为:2M⇌N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍难度: 中等查看答案及解析
-
一定温度下,在容积不变的密闭容器中发生反应:2NO2(g)⇌2NO(g)+O2(g),能说明该反应已达化学平衡状态的是( )
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③容器内气体的压强不再改变
④混合气体的颜色不再改变
⑤混合气体的密度不再改变.
A.①②④
B.②③⑤
C.①③④
D.①②③④⑤难度: 中等查看答案及解析