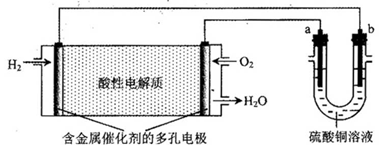
-
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)
-
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。
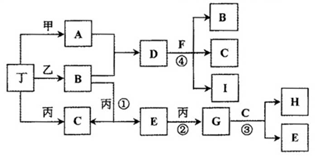
请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol •L-1 B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol • L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol • L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
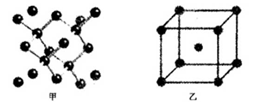
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
-
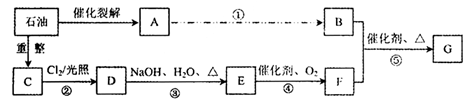
聚酯纤维在服装、室内装饰和工业领域中有广泛应用。下图是合成某种聚酯纤维G 的流程图。
请回答下列问题:
已知:质谱图表明F的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;F能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明D、F分子中均有两种类型的氢原子,且D分子中两种类型的氢原子的个数比为1:1。
(1) A在一定的条件下可以制备酒精,则A的结构式为________。
(2) 从A到B,工业上一般通过两步反应来完成,则在其第一步的反应中一般采用的化学试剂是______,第二步反应类型为___________。若此处从原子利用率100%的角度考虑,通过A与某种无机物一步合成B,该无机物的化学式是________。
(3)写出B物质与乙酸完全酯化后生成的有机物的名称________。
(4)写出反应⑤的化学方程式: ________。
(5)在一定条件下,若1mol F与1 mol甲醇恰好完全反应生成1mol H和1mol水,H有多种同分异构体,写出同时符合下列条件H的同分异构体的一种结构简式;
a.该有机物呈中性,但1 mol该有机物最多能与4md NaOH溶液在一定条件下反应
b.该有机物苯环上只有2个取代基,其苯环上的一氯代物只有两种
C.1 mol该有机物与银氨溶液反应最多能生成2molAg
,有关柠檬烯的分析正确的是
)互为同分异构体