-
“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 生活垃圾分类收集 B. 垃圾进行露天焚烧
C. 宣传“低碳”出行 D. 合理使用化肥农药
难度: 简单查看答案及解析
-
下列有关氮元素及其化合物的表示正确的是
A. 质子数为7、中子数为8的氮原子:
B. 氮离子(N3-)的结构示意图:
C. 氨分子的电子式:
D. 硝基苯的结构简式:
难度: 中等查看答案及解析
-
下列说法正确的是
A. 铝有较高熔点,可做耐火材料
B. SO2能使溴水褪色,体现其漂白性
C. 氨气是电解质,因为氨气的水溶液能导电
D. 钠钾合金可用于快中子反应堆的热交换剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol·L-1NaOH溶液中Na+的数目为0.1NA
B. 标准状况下,2.24 L CCl4中的分子数目为0.1NA
C. 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1NA
D. 3.2 g O2和O3的混合物含有的分子数目为0.1NA
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH = 1的溶液中:Fe2+、K+、NO3-、SO42-
B. c (Fe3+)=" 0.1" mol·L-1的溶液中:Na+、NO3-、SCN-、SO42-
C. 使酚酞试液变红色的溶液中:Na+、Ba2+、I-、Cl-
D. 水电离的c (H+)= 1×10-13 mol·L-1的溶液中:K+、Na+、NO3-、HCO3-
难度: 中等查看答案及解析
-
下列实验操作正确的是
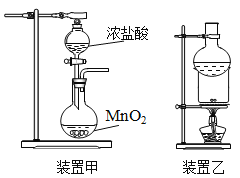
A. 用装置甲可以制备氯气
B. 用装置乙分离泥沙中的碘单质
C. 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘
D. 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的是
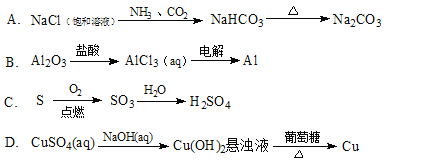
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 制作印刷电路板: Fe3++ Cu = Fe2++ Cu2+
B. Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+ Ca2++ OH-= CaCO3↓ + H2O
C. 用NaOH溶液吸收Cl2: Cl2+ 2OH-= Cl-+ ClO3-+ H2O
D. 明矾常用于净水:Al3++ 3H2O
Al(OH)3(胶体)+ 3H+
难度: 中等查看答案及解析
-
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
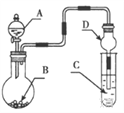
A. 若A为H2O2,B为MnO2,C中盛有Na2S溶液, C中溶液变浑浊
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液, C中先产生白色沉淀后沉淀又溶解
D. 若A为浓H2SO4 ,B为CaCO3,C中盛有Na2SiO3 溶液,C中溶液出现白色沉淀,证明非金属性S>C>Si
难度: 困难查看答案及解析
-
有序思维模式有利于解决复杂混合体系中的化学问题。下列反应先后顺序判断正确的是
A. 在含等物质的量的CO32-、OH-的溶液中,逐滴加入稀盐酸: OH-、CO32-、HCO3-
B. 在含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液: Al3+、Al(OH)3、NH4+
C. 在含铁和铜的混合物中逐滴加入稀硝酸:Fe、Cu、Fe2+
D. 惰性电极电解含等物质的量Zn2+、Al3+溶液时阴极电极反应:Zn2+、Al3+、H+
难度: 困难查看答案及解析
-
下列设计的实验方案能达到实验目的的是
A. 制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶
B. 提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶
C. 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象
D. 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化
难度: 中等查看答案及解析
-
根据下列实验现象所得结论正确的是
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液未呈血红色
稀硝酸不能将Fe氧化为Fe3+
B
向NaAlO2溶液中滴入NaHCO3溶液
产生白色沉淀
AlO2-结合H+的能力比CO32-强
C
已知Cu2O + 2H+= Cu2++ Cu + H2O
将氢气还原氧化铜后所得红色固体
投入足量稀盐酸溶液呈蓝色
CuO的还原产物不全部是Cu
D
将0.1 mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液
先有白色沉淀生成,后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的大
难度: 中等查看答案及解析
-
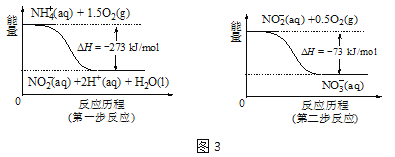
通过以下反应可以除去烟气中的二氧化硫,并获得氮肥。下列说法不正确的是
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) △H1=akJ·mol-1
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l) △H2=bkJ·mol-1
③2(NH4)2SO3(ap)+O2(g) = 2(NH4)2SO4(aq) △H3=ckJ·mol-1
A. 反应①是吸收烟气中二氧化硫的方法之一
B. 反应③是将还原性较强的(NH4)2SO3转化为较稳定的铵盐作氮肥
C. 2NH3·H2O(aq)+2NH4HSO3(aq)=2 (NH4)2SO3(aq)+2H2O(g) △H2=2bkJ·mol-1
D. 反应2SO2(g)+4NH3·H2O(aq)+O2(g) = 2(NH4)2SO4(aq)+2H2O(l)的△H=(2a+2b+c)kJ·mol-1
难度: 中等查看答案及解析
-
锌冶炼过程中会产生大量的铅浮渣,其主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。利用铅浮渣生产硫酸铅的流程如下。下列说法不正确的是
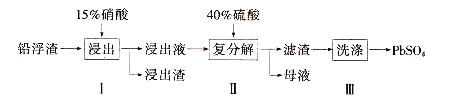
A. 步骤Ⅰ中反应的离子方程式是:Pb+4H++2NO=Pb2++2NO↑+2H2O
B. 复分解反应的方程式是:Pb(NO3)2+H2SO4= PbSO4↓+2HNO3
C. 为保证产品纯度,需控制硝酸的量以为防止Ag被溶解
D. 步骤Ⅱ得到的粗产品PbSO4 含有少量CaSO4杂质,还需用Pb(NO3)2溶液多次洗涤
难度: 困难查看答案及解析