-
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
-
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1 FeSO4溶液V1 mL(过量),以如图所示装置煮沸。
步骤6:冷却,用c mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2 mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④ 该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
-
一定温度和电压下,电解精制食盐水可制取NaClO3。电解装置如图。已知:3Cl2 + 6OH- = ClO3- + 5Cl- + 3H2O。下列说法正确的是
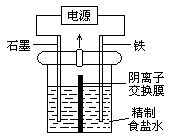
A.铁为阳极,电极反应式为2H2O + 2e- = H2↑+ 2OH-
B.若阴极产生3.36L(标况)气体,则溶液中的反应转移电子0.30mol
C.电解槽内总反应方程式为:NaCl + 3H2O  NaClO3 + 3H2↑
NaClO3 + 3H2↑
D.用阳离子交换膜代替阴离子交换膜,也一样可以制得NaClO3
-
已知一定量的氢气在氯气中燃饶,所得混合物用500mL 6.0 mol·L-1的KOH溶液恰好完全吸收,测得溶液中含有ClO- 0.20 mol、ClO3-0.30 mol(忽略氯气与水反应、盐类水解及溶液体积变化)。回答下列问题。
(1)所得溶液中c(Cl-)为________mol·L-1。
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
-
下列关于实验室模拟侯德榜制碱法的操作正确的是( )
A.将CO2和NH3的混合气体同时通入饱和食盐水
B.将析出的NaHCO3固体过滤洗涤后灼烧得到纯碱
C.在析出NaHCO3的母液中加入消石灰以循环利用NH3
D.在析出NaHCO3的母液中通入NH3,析出NH4Cl固体
-
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
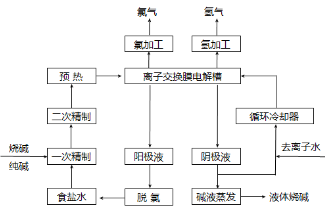
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
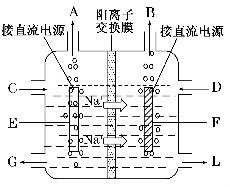
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
-
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图所示:
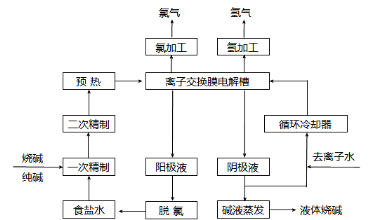
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由 于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 , E电极的名称是 。电解总反应的离子方程式为 。

(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
-
下列离子反应方程式正确的是( )
A.用铁棒电极电解饱和食盐水:2Cl-+2H2O═2OH-+H2↑+Cl2↑
B.工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
C.向饱和Na2CO3溶液中通入CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓
D.Ba(OH)2溶液中滴入NaHSO4溶液至恰好呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
-
下列化学工业中,未涉及原料循环使用的是
A.侯德榜制碱法 B.索尔维制碱法
C.工业电解饱和食盐水 D.工业炼铁
-
已知四种盐的溶解度(s)曲线如图所示,下列说法不正确的是( )
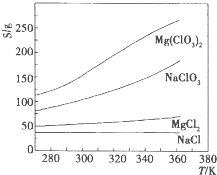
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
2Cl-+ClO3-,该反应的平衡常数表达式为 。







