-
下列说法正确的是( )
A.用高氯酸与碳酸钙反应制取二氧化碳可证明氯元素非金属性大于碳元素
B.糖类、油脂、蛋白质在一定条件下都能发生水解反应
C.硅单质在电子工业上应用广泛,可做光导纤维
D.石油的裂化产生气体、植物油以及苯甲酸均能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列说法正确的是
A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B.标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA
C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
D.在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为
2CaCO3 +O2+2SO2
2CaSO3 +2CO2
难度: 困难查看答案及解析
-
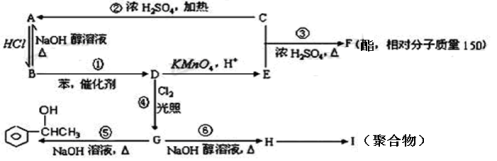
下列有关有机化合物结构和性质的叙述,正确的是( )
A.乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应
B.C8H10含苯环的烃的同分异构体有3种
C.
 分子中的所有原子不可能共平面
分子中的所有原子不可能共平面D.莽草酸(
)能与溴水发生取代反应而褪色
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
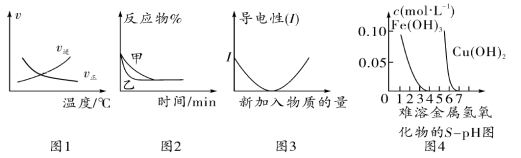
A.根据图1可判断可逆反应“A2(g)+3B2(g)
2AB3(g)”的 ΔH<0
B.图2可能表示压强对可逆反应 A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右
难度: 困难查看答案及解析
-
下列有关物质制取或性质探究实验设计不能达到实验目的的是( )
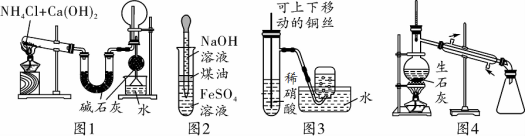
A.利用图1制取并收集干燥的氨气
B.利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化
C.利用图3制取并收集NO气体
D.利用图4以医用酒精为原料制取无水乙醇
难度: 中等查看答案及解析
-
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比
为l:l:6。下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为l
D.向该溶液中加入过量铁粉,只发生置换反应
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A.常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S)
B.常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:
c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-)
D.常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中
的值减小到原来的
难度: 困难查看答案及解析
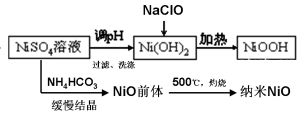
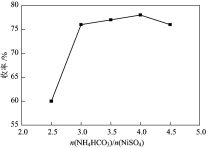
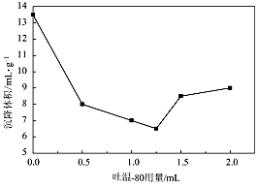


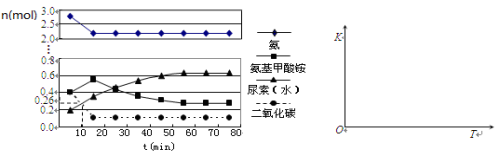
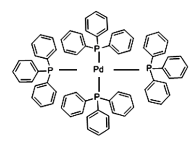

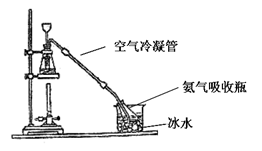
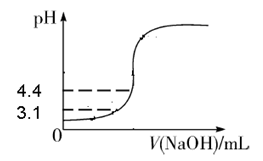
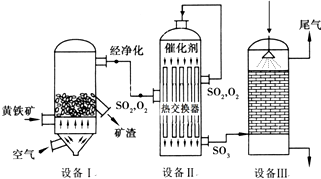
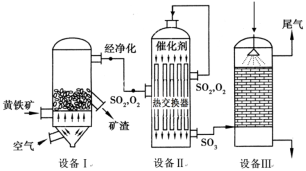 (1)依据工艺流程图判断下列说法不正确的是(选填序号字母)___________。
(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)___________。