-
工业生产硝酸铵的流程如下图所示:

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点比N点的反应速率快
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K ≈ 0.93 L2/mol2
(3)尿素[ CO(NH2)2 ]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: 。
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:
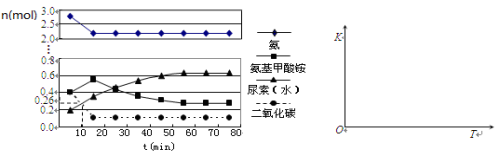
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
(5)电解尿素[ CO(NH2)2 ]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
-
工业生产硝酸铵的流程如下图所示:

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第___________步反应决定,总反应进行到_______min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
③在上面右图中画出第二步反应的平衡常数K随温度的变化的示意图。
-
工业生产硝酸铵的流程如下图所示

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
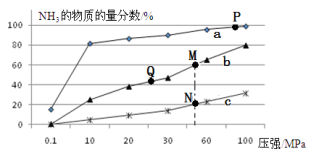
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点比N点的反应速率快
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: ;
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:
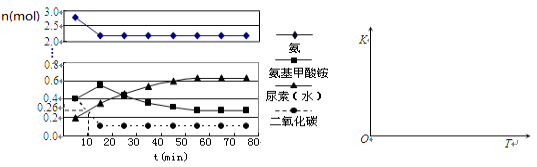
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
-
工业生产硝酸铵的流程如下图所示

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点对应的H2转化率是75%
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________mol·L-1·min-1。
③在右图中画出第二步反应的平衡常数K随温度的变化的示意图。
-
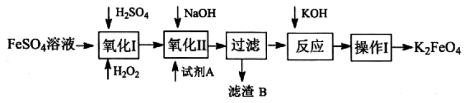
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
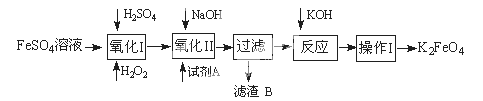
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式________。
(2)氧化II中,试剂A为(填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有________
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用________洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: ________K2FeO4 + ________ H2O = ________Fe(OH)3↓ + ________KOH + ________
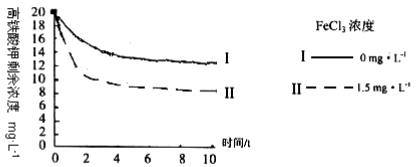
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是________。

-
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O  Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。
(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.
方法Ⅰ:次氯酸盐氧化法,工艺流程如图.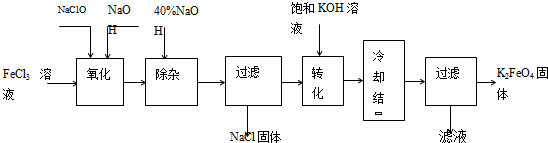
(1)完成“氧化”过程中反应的化学方程式:
______FeCl3+______NaOH+______NaClO→______ Na2FeO4+______d+______d其中氧化剂是______(填化学式).
(2)“转化”过程中发生反应的化学方程式为______.
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用______溶解,然后______.
方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为______.
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图

(1)“氧化”过程中的氧化剂是________(填化学式)。比较NaClO、Na2FeO4的氧化性强弱(填<、=、>)________。
“除杂”除去的是________。
(2)“转化”过程中发生的化学反应方程式为________,与我们见过的分离混合物的原理相似。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后。
方法Ⅱ:电解法。
(4)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入 。
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。

(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______ +______
+______ 。____________其中氧化剂是________(填化学式)。
。____________其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________。
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。

(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。

2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。


















