-
2009年12月7日,《联合国气候变化框架公约》第15次缔约方会议在丹麦首都哥本哈根召开,192个国家和地区的代表出席了会议。此次会议被视为全人类联合遏制全球变暖行动一次很重要努力。下列能使气候变暖的气体是 ( )
A.NO2 B.SO2 C.H2S D.CO2
难度: 简单查看答案及解析
-
生活中碰到的某些问题,常需要用化学知识解释,下列说法不正确的是 ( )
A.医疗中用75%的乙醇溶液进行消毒,是由于蛋白质遇酒精会变性
B.臭氧可用于自来水消毒,是因为臭氧具有强氧化性能杀死水中的病菌
C.食盐中加入少量碘酸钾,食用后可补充人体内碘元素的不足
D.腌制熟食品时,添加少量NaNO2,是为了使其味道更加美味可口
难度: 简单查看答案及解析
-
下列关于有机物的说法中,正确的一组是 ( )
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
A.①②⑤ B.①②④ C.①③⑤ D.③④⑤
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法。下列有关分类合理的有 ( )
①根据酸分子所含的氢原子数目的多少将酸分为一元酸、二元酸等
②根据反应中电子的转移数目的多少可将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属和非金属
④根据反应的热效应将化学反应分为放热反应和吸热反应
A.有1项 B.有2项 C.有3项 D.有4项
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.汽油、煤油、柴油和植物油都是碳氢化合物
B.石油、煤和太阳能、潮汐能都属于绿色能源
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.以石油、煤和天然气为原料,可生产塑料、合成橡胶和合成纤维等材料
难度: 简单查看答案及解析
-
下列物质不能用来鉴别乙酸、乙醇、苯的是 ( )
A.碳酸氢钠溶液 B.紫色石蕊溶液
C.溴水 D.酸性高锰酸钾溶液
难度: 简单查看答案及解析
-
下列各组干燥气体和溶液,其中可以进行喷泉实验,且液体几乎充满烧瓶的是 ( )
A.Cl2,饱和食盐水 B.CO2,碳酸氢钠溶液
C.SO2,稀氨水 D.NO2,H2O
难度: 简单查看答案及解析
-
下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是 ( )
A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少
B.气态氢化物溶于水后的酸性,X比Y强
C.X的最高正价比Y的最高正价高
D.X单质能与Y的氢化物反应生成Y单质
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.用氯气作为水的消毒剂:Cl2+H2O===2H++Cl-+ClO-
B.胃药里含氢氧化铝能降低胃酸:Al(OH)3+3H+===Al3++3H2O
C.用氨水吸收过量二氧化硫气体:2NH3·H2O+SO2===2NH+4+SO2-3+H2O
D.用醋酸清洗暖瓶中的水垢:CaCO3+2H+===Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
下列关于实验仪器的使用说法错误的是 ( )
A.分液漏斗、容量瓶、滴定管使用前需要检查是否漏水
B.在强酸与强碱中和滴定实验中,无论是酸滴定碱还是碱滴定酸,都可以测出待测液的物质的量浓度
C.烧杯、圆底烧瓶、蒸发皿都可以直接用来加热
D.使用容量瓶配制溶液,在定容时仰视会使所配制的溶液浓度偏低
难度: 简单查看答案及解析
-
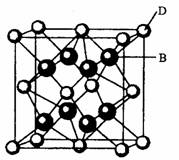
科学家最近在—100℃的低温下合成一种烃X,此分子的模型如下图(图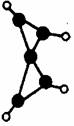
中的连线表示化学键),下列说法正确的是 ( )
A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数) ( )
A. 11.2 L乙烷中所含的碳氢单键数为3N。
B.1 L1 mol·L-1的氯化铁溶液中铁离子的数目为N。
C.56 g铁发生氧化反应,一定失去3NA个电子
D.常温常压下,100 mL 0.5 mol/L的乙酸溶液中,乙酸的分子数目小于0.05N。
难度: 中等查看答案及解析
-
下列溶液中的离子一定能大量共存的是 ( )
A.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO2-4;、NO-3
B.室温下由水电离出来的氢离子浓度c(H+)=1×10-14 mol/L的溶液中:Ba2+、NO-3、K+、CIO-
C.能使酚酞变红色的溶液中:Na+、K+、AlO-2、CO2-3
D.含大量Fe3+的溶液中:NH+、Na+、C1-、SCN-
难度: 中等查看答案及解析
-
在下列条件下能制得括号中物质的是 ( )
A.苯在常温下与浓硝酸混合(
)
B.将乙烯通入到水中(CH3CH2OH)
C.甲苯与氯气在氯化铁催化下反应(
)
D.乙醇在银催化下加热与氧气反应(CH3CHO)
难度: 简单查看答案及解析
-
下列反应中,反应物的用量或浓度改变时,不会改变生成物的是 ( )
A.铁与硝酸反应 B.硫在氧气中燃烧
C.碳酸钠溶液和醋酸溶液反应 D.明矾溶液与烧碱溶液反应
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.在8NH3+3Cl2===N2+6NH4Cl反应中氧化剂与还原剂物质的量之比是2:3
D.已知还原性:Fe2+>Br-可知反应2Fe3++2Br-==2Fe2++Br2不易进行
难度: 中等查看答案及解析
-
在溶液中有浓度均为0.01 mol/L的Fe2+、Cr3+、Zn2+、Mg2+等离子,已知:
KspFe(OH)3===2.6×10-39;KspCr(OH)3==7.0×10—31
KspZn(OH)2===1. 0×10-17;KspMg(OH)2=1.8×10-11
当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小 ( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
难度: 中等查看答案及解析
-
一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐),家庭常用的漂白水,食盐,氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应方程式为2A1+3ClO-+2OH-== 3C1-+2AlO-2+H2O。下列说法不正确的是 ( )
A.该电池的优点是电极材料和电解质用完后可以更换
B.该电池发生氧化反应的是金属铝
C.电极的正极反应式为3ClO-+3H2O+6e-==3Cl-+6OH-
D.当有0.1mol Al完全溶解时,流经电解液的电子个数为1.806×1023
难度: 中等查看答案及解析
-
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl混合而成,为检验它的成分做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。则该固体混合物中 ( )
A.肯定有Na2SO4 可能有CuSO4 B.一定有NaCl 肯定没有Na2SO4
C.一定有Na2CO3 可能有NaCl D.可能有CaCl2 一定没有CuSO4
难度: 极难查看答案及解析
-
A、B、C、D、E五种元素具有相同的电子层数,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是 ( )
A.CDEAB B.:ECDAB C.BAEDC D.BADCE
难度: 中等查看答案及解析
-
下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是 ( )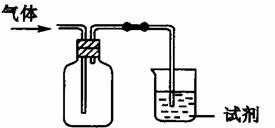
选项
气体
试剂
现象
结论
A
SO2
酸性KMnO4溶液
溶液褪色
SO2有氧化性
B
C2H4
溴水
溶液褪色
能发生加成反应
C
X
澄清石灰水
溶液变浑浊
X不一定是CO2
D
Cl2
紫色石蕊试液
溶液先变红后褪色
Cl2有酸性和漂白性
难度: 中等查看答案及解析
-
下列选项中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol/L的Na2CO3溶液中:c(OH-)==c(HCO-3)+c(H+)+c(H2CO3)
B.0.1mol/LNH4Cl的溶液与0.5mol/L的NaOH溶液等体积混合后,得到的溶液中:
c(Cl-)>c(Na+)>c(NH+4)>c(OH-)>c(H+)
C.向硝酸钾溶液中滴加稀盐酸得到pH=4的混合溶液:c(K+)==c(NO-3)
D.浓度分别为0.1mol/L和0.01mol/L的CH3COOH溶液中:
CH3COO-离子浓度前者是后者的10倍
难度: 中等查看答案及解析
-
将17.9 gAl、Fe、Cu组成的合金溶于足量的:NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 LNO(标况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为 ( )
A.33.2 g B.25.4 g C.22.4 g D.19.6 g
难度: 中等查看答案及解析
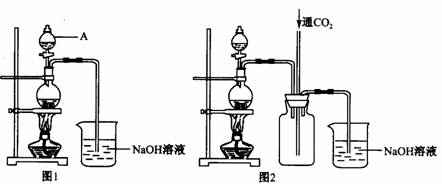
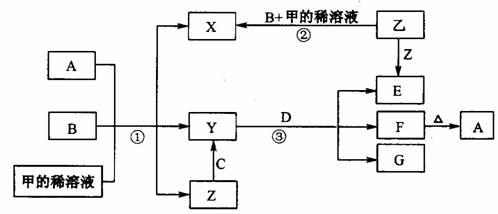
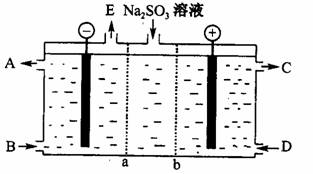

 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式