-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为热能的是
A
B
C
D




硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
难度: 简单查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
C(s)+
O2(g)=CO(g) △H=―393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=―890.3kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800kJ/mol
难度: 中等查看答案及解析
-
下列说法正确的是
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生反应
C.反应物和生成物分别具有的总能量的相对大小决定了反应是放热反应还是吸热反应
D.当△H<0时表明反应为吸热反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.CH4(g) + 3/2O2(g) == CO(g) +2H2O(l) ΔH== -a kJ·mol—1 ,这里ΔH代表燃烧热
B.在250C、101kPa,1mol硫和2mol硫的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
难度: 中等查看答案及解析
-
下面均是正丁烷与氧气反应的热化学方程式(25 ℃,101 kPa):
①C4H10(g)+
O2(g) = 4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+
O2(g) = 4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+
O2(g) = 4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+
O2(g) = 4CO(g)+5H2O(g) ΔH=-1 526 kJ·mo-1
由此判断,正丁烷的燃烧热ΔH为
A.-2 878 kJ·mol-1 B.-2 658 kJ·mol-1
C.-1746 kJ·mol-1 D.-1526 kJ·mol-1
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
难度: 中等查看答案及解析
-
硫代硫酸钠(Na2S2O3)与稀H2SO4溶液时发生如下反应:
Na2S2O3+ H2SO4=Na2 SO4+SO2+S↓+H2O 下列反应速率最大的是
A.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃
B.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃
C.0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃
D.0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃
难度: 中等查看答案及解析
-
已知化学反应2C(s)+O2(g)
2CO(g);2CO(g) + O2(g)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.28gCO所具有的能量一定高于12gC所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份等质量碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
难度: 中等查看答案及解析
-
已知2 H2(g) + O2(g) = 2 H2O(g) ΔH = — 483.6 kJ/mol。下列说法不正确的是
A.该反应的反应热ΔH =—483.6 kJ/mol
B.H2的燃烧热ΔH = —241.8 kJ/mol
C.2mol H2完全燃烧生成液态水放出的热量大于483.6 kJ
D.形成2 mol H2O的化学键释放的总能量大于断裂2 mol H2和1 mol O2 的化学键所吸收的总能量
难度: 中等查看答案及解析
-
分析下面的能量变化图,判断下列选项中正确的是
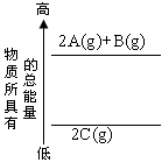
A.2A+B = 2C △H<0
B.2C(g) = 2A(g)+B(g) △H<0
C.2A(g)+B(g) = 2C(g) △H>0
D.2A(g)+B(g) = 2C(g) △H<0
难度: 中等查看答案及解析
-
已知:H2(g) + F2(g) = 2HF(g) △H =-270 kJ· mol-1,下列说法正确的是
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
难度: 中等查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
A. 0.2Q B. 0.1Q
C. 5Q D. 10Q
难度: 中等查看答案及解析
-
已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
101KPa ② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热等于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
难度: 中等查看答案及解析
-
氢气、一氧化碳、葡萄糖、甲烷燃烧的热化学方程式分别为
H2(g)+
O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+
O2(g) = CO2(g) ΔH=-283.0 kJ·mol-1
C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是
A.C6H12O6 B.CH4 C.H2 D.CO
难度: 中等查看答案及解析
-
在36 g 碳不完全燃烧所得气体中,CO占
体积,CO2占
体积,且
C(s) +
O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) +
O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是
A.172.5 kJ B. 1149 kJ C.283kJ D. 517.5 kJ
难度: 中等查看答案及解析
-
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B.Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
难度: 中等查看答案及解析
-
已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨)+O2(g)= CO2(g) △H=-393.51 kJ• mol-1
C(金刚石)+O2(g)= CO2(g) △H=-395.41 kJ• moL-1
据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)=0.4 mol / L·s B.υ(C)=0.5 mol / L·s
C.υ(B)=0.6 mol / L·s D.υ(A)=0.15 mol / L·s
难度: 中等查看答案及解析
-
有关碰撞理论,下列说法中不正确的是
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
难度: 中等查看答案及解析
-
下列关于糖类的说法正确的是
A.葡萄糖能发生氧化反应和水解反应
B.葡萄糖和果糖的分子式都是C6H12O6,二者互为同分异构体
C.淀粉和纤维素的组成均可用(C6H10O5)n表示,因此它们互为同分异构体
D.纤维素在人体内不能水解生成葡萄糖,因此对人体健康无益
难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉和纤维素都可以作为工业上生产葡萄糖的原料
C.糖类、油脂、蛋白质在一定条件下都能发生水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
难度: 中等查看答案及解析
 ii.
ii.