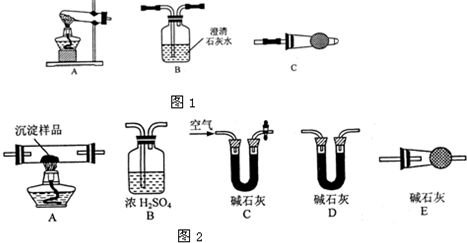
-
用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是S2-,氧化剂是Fe3+
C.氧化产物是S,还原产物是Cu2+和Fe2+
D.当转移1mol电子时,46 g CuFeS2参加反应难度: 中等查看答案及解析
-
液态锂离子电池是Li+嵌入化合物的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法错误的是( )
A.LiCoO2改写为氧化物的形式为:Li2O•Co2O3
B.该电池的电解液使用有机溶剂主要是由于有机溶剂与锂盐有很好的互溶性
C.该电池充电时的反应为:Li++6C+xe-=LixC6+(1-x)Li+
D.放电时电解质中PF6-和AsF6-等离子向负极移动难度: 中等查看答案及解析
-
澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的关系是( )
A.同系物
B.同分异构体
C.同位素
D.同素异形体难度: 中等查看答案及解析
-
化学与生活、社会密切相关.下列说法错误的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染难度: 中等查看答案及解析
-
某高聚物的结构片段如图,下列分析正确的是( )
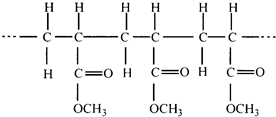
A.它是缩聚反应的产物
B.其单体是CH2=CH2和HCOOCH3
C.其链节是CH3CH2COOCH3
D.其单体是CH2=CHCOOCH3难度: 中等查看答案及解析
-
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
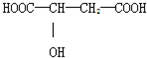
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能发生消去反应
D.1mol苹果酸与Na2CO3溶液反应必须消耗2molNa2CO3难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.1L 1mol•L-1的HAc溶液中含有6.02×1023个氢离子
B.18g D2O(重水)完全电解,转移6.02×1023个电子
C.22.4L SO2气体,所含氧原子数为2×6.02×1023
D.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023难度: 中等查看答案及解析
-
六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应.下列有关SF6的推测正确的是( )
A.SF6易燃烧生成二氧化硫
B.SF6中各原子均达到 8 电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF
D.SF6是极性分子难度: 中等查看答案及解析
-
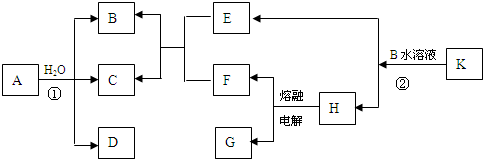
下列4组连线中,完全正确的一组是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.
B.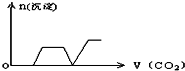
C.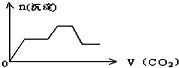
D.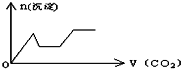
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4ClNH3↑+HCl↑
B.CaO+3CCaC2+CO↑
C.2Na2O2+2CO2═2Na2CO3+O2
D.2NaOH+Cl2═NaCl+NaClO+H2O难度: 中等查看答案及解析
-
下列比较中,可能正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大
B.0.2 mol•L-lNH4Cl 和 0.l mol•L-lNaOH 溶液等体积混合后:c(NH4+)>c (Cl-)>c (Na+)>c (OH-)>c (H+)
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+)+c(H+)=c (S2-)+c (HS-)+c (OH-)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+) 由大到小的顺序是:①>②>③>④难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑
B.向KI与稀硫酸的混合溶液中通入氧气:2H++O2+2I-═I2+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O难度: 中等查看答案及解析
-
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施难度: 中等查看答案及解析
-
可逆反应aA(s)+bB(g)⇌cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
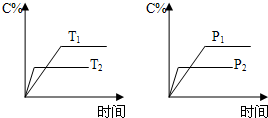
A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,若升高温度,平衡向左移动
C.化学方程式中b>c+d
D.达平衡后,增加A的量,有利于平衡向右移动难度: 中等查看答案及解析