-
环境问题与我们的生活息息相关,也是目前召开的两会热点之一,家用合成洗衣粉的主要成份是对十二烷基苯磺酸钠,为提高洗衣粉的洗涤效果,往往加入一定量的下列助洗剂,其中对环境有较严重影响的是
A.磷酸钠(Na3PO4) B.硫酸钠(Na2SO4)
C.硅酸钠(Na2SiO3) D.碳酸钠(Na2CO3)
难度: 简单查看答案及解析
-
下列对应的表达方式错误的是
A .Cl-的结构示意图
B.2—甲基丁烷
C.碳-12原子
C D.硫离子的核外电子排布式 1s22s22p63s23p4
难度: 中等查看答案及解析
-
下列工业生产中,有关关系式错误的是
A.漂白粉:2Cl2—Ca(ClO)2 B.H2SO4:FeS2—2H2SO4
C.氨:C—H2—2/3 NH3 D.HNO3: NH3—HNO3
难度: 中等查看答案及解析
-
生活中下列处理方法正确的是
A.蚂蚁叮咬的红肿处涂沫苯酚止痒 B.冬天在汽车水箱中加乙二醇抗冻
C.纺织品上的油腻用烧碱溶液清洗 D.把铁器具浸入水隔绝空气防生锈
难度: 中等查看答案及解析
-
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应:
①Si(s)+3HCl(g)
SiHCl3(g)+H2(g) +381 kJ
②SiHCl3(g)+H2(g)
Si(s)+3HCl(g)
对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.反应②是吸热反应
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
难度: 中等查看答案及解析
-
右表各组物质中,满足下图物质一步转化关系的选项是
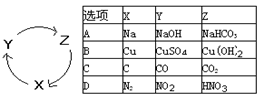
难度: 中等查看答案及解析
-
X.Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
A.酸A中X的化合价比酸B中Y化合价高
B.酸A中X与酸B中Y在同一周期,且X在Y之后
C.酸A与酸B的铵盐溶液反应生成酸B
D.酸A具有强氧化性,酸B没有强氧化性
难度: 中等查看答案及解析
-
蛇纹石由MgO.A12O3.SiO2.Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述错误的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+.Al3+.Fe3+.H+
难度: 中等查看答案及解析
-
醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的的是
A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-)
C.c(H+) = c(OH-)-c(CH3COOH)
D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
难度: 困难查看答案及解析
-
下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是:
A.苯酚.碳酸钠 B.硫酸.氢氧化钡
C.氯化铝.氨水 D.二氧化碳.氢氧化钠
难度: 中等查看答案及解析
-
见下表。欲用一种试剂甲来检验其溶液中的离子X,在同时有离子Y存在时,此检验仍可进行的是(在实验过程中不允许加热.过滤.萃取……等操作)
试剂甲 离子X 离子Y
A HCl.Ba(OH)2 CO32- HCO3-
B NH3 .H2O Al3+ Mg2+
C AgNO3 I- Cl-
D NH4SCN,氯水 Fe2+ Fe3+
难度: 中等查看答案及解析
-
下列反应的离子方程式或热化学方程式书写正确的是
A.除去KNO3溶液中的Fe3+: Fe3++3NH3﹒H2O→Fe(OH)3↓+3NH4+
B.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+→2Fe3++2H2O
C.硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-→BaSO4↓
D.1L 0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq) → Na2SO4(aq)+2H2O(1)+57.3kJ
难度: 困难查看答案及解析
-
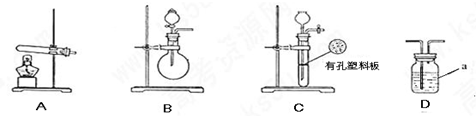
下列实验设计能够成功的是
实验目的 实验步骤及现象
A 检验亚硫酸钠试样是否变质

B 检验某卤代烃是否是氯代烃

C 证明酸性条件H2O2氧化性比I2强

D 除去铁屑表面的油污 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净
难度: 中等查看答案及解析
-
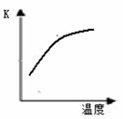
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
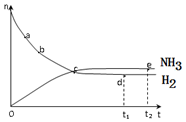
下列叙述正确的是
A.点a的正反应速率比点b的小
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
难度: 困难查看答案及解析
-
下列叙述中指定粒子数目一定大于NA的是
A.常温常压下,11.2LN2和NO的混合气体所含的原子数
B.1molCl2参加化学反应获得的电子数
C.1L1mol/LCH3COOH溶液中所含分子总数
D.28g铁在反应中作还原剂时,失去电子的数目
难度: 中等查看答案及解析
-
将下列各组物质提纯分离或除杂,可采用相同的实验方法和原理的是
A.除去苏打中混有的少量小苏打杂质;除去氯化钠中混有的碘单质
B.分离硝酸钾与氯化钠;分离氯化铁和氯化铜稀溶液
C.除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳
D.除去乙醛中溶有的少量乙酸;除去乙醇中溶有的少量苯酚
难度: 中等查看答案及解析
-
0.001mol金属放入10mL0.1mol/L某酸溶液中,产生22.4mL氢气(标准状况),下列情况中一定不可能的是
A.一价金属和一元酸 B.二价金属和二元酸
C.三价金属和二元酸 D.二价金属和一元酸
难度: 中等查看答案及解析
-
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.4moNH3参加反应失去12mol电子
难度: 中等查看答案及解析
-
现有下列短周期元素性质的数据:
元素编号
元素性质
①
②
③
④
⑤
⑥
⑦
⑧
原子半径
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
下列说法正确的是
A.原子序数④元素大于⑦元素
B.②.③处于同一周期
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为:
难度: 中等查看答案及解析
-
坚决反对运动员服用兴奋剂,公平竞赛。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.该物质在一定条件下可以发生取代.加成.加聚.氧化.还原等反应
D.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol.7 mol
难度: 中等查看答案及解析
-
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
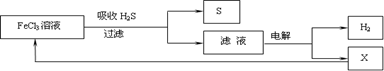
A.吸收H2S的离子方程式为:2Fe3++H2S→2Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl- - 2e-→Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染
难度: 中等查看答案及解析
-
11.9g金属锡(Sn)跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是
A.SnO2·4H2O B.Sn(NO3)4
C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
难度: 中等查看答案及解析
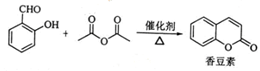
 ,反应涉及到的物质中,X属于________
,反应涉及到的物质中,X属于________