-
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是( )
选项
古文或谚语
化学解释
A
日照香炉生紫烟
碘的升华
B
以曾青涂铁,铁赤色如铜
置换反应
C
煮豆燃豆萁
化学能转化为热能
D
雷雨肥庄稼
自然固氮
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.二氧化硅的分子式 SiO2
B.质子数为53,中子数为78的碘原子
C.羟基的电子式
D.次氯酸的结构式:H﹣Cl﹣O
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下的22.4L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
难度: 困难查看答案及解析
-
常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
A.加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO-
B.含有大量ClO-的溶液中:K+、Na+、NO3-、SO42-
C.c(Cu2+)=0.1 mol·L-1的溶液中:H+、NH4+、Br-、CO32-
D.含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是( )
A.明矾净水:Al3+ + 3H2O
Al(OH)3(胶体)+ 3H+
B.用稀HNO3清洗试管内壁上的银:Ag + 2H+ + NO3-═ Ag+ + NO2↑+ H2O
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-═ SiO32- + H2O
D.焊接钢轨:2Al+Fe2O3
2Fe+Al2O3
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.氢氧化铁溶于氢碘酸溶液中:Fe(OH)3+3HI═Fe3++3I-+3H2O
B.少量CO2通入苯酚钠溶液中:

C.向NaAlO2溶液中通入足量CO2:2AlO
+3H2O+CO2═2Al(OH)3↓+CO32-
D.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO
+2OH-═CaCO3↓+CO32-+2H2O
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向某溶液中加入盐酸酸化的BaCl2溶液
生成白色沉淀
该溶液中不一定含有SO42﹣
B
步骤1:将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置;
步骤2:向上层溶液中滴加KSCN溶液,再向上层溶液中滴加溴水
步骤1现象:
液体分层,下层溶液呈紫色;
步骤2现象:
滴加KSCN溶液,上层溶液不变红;滴加溴水后,上层溶液变红
氧化性:Br2>Fe3+>I2
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
D
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al
难度: 困难查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是( )
A. 原子半径:D>E>C>B>A
B. 热稳定性:EA4>A2C
C. 单质D可用海水作原料获得
D. 化合物DC与化合物EC2中化学键类型相同
难度: 中等查看答案及解析
-
磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol。下列推断正确的是( )
A.磷酸与氢氧化钠反应能生成2种盐
B.NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐
C.H3PO4、H3PO3、H3PO2都是含氧酸
D.H3PO3是三元酸,又是还原性酸
难度: 中等查看答案及解析
-
将1 mol Na2O2与2 mol NaHCO3固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3
B.Na2O2、Na2CO3
C.NaOH、Na2CO3
D.Na2O2、NaOH、Na2CO3
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物 B.若生成4.48 L HF,则转移0.8 mol电子
C.O2F2既是氧化剂又是还原剂 D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列各种关于酸的使用,其中正确的是( )
A.为了抑制Fe2+的水解,用稀硝酸酸化
B.为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
C.检验溶液中是否含有SO42﹣时,先用盐酸酸化
D.检验氯乙烷中的氯元素,水解后再用硫酸酸化
难度: 中等查看答案及解析
-
Fe和Mg与H2SO4反应的实验如下:
实验
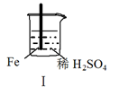


现象
Fe表面产生大量无色气泡
Fe表面产生气泡后迅速停止
Mg表面迅速产生大量气泡
Fe表面有大量气泡,Mg表面有少量气泡
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
难度: 中等查看答案及解析
-
2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:

下列说法不正确的是( )
A.青蒿素的分子式是C15H21O4
B.青蒿素可以发生水解反应
C.反应②有H2O生成
D.双氢青蒿素中含有与H2O2分子中相同的化学键
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其适用范围,据有关“规律”下列结论合理的是( )
A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B.金属钠可以通过电解熔融NaCl制得,推出金属铝可以通过电解熔融AlCl3制得
C.金属钠在纯氧中燃烧生成Na2O2,推出金属锂在纯氧中燃烧生成Li2O2
D.CaCO3与稀硝酸反应生成CO2,推出CaSO3也能与稀硝酸反应生成SO2
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 困难查看答案及解析