-
废电池造成污染的问题日益受到关注,集中处理废电池的首要目的是
A.回收石墨电极
B.回收电池外壳的金属材料
C.防止电池中渗泄的电解液腐蚀其他物品
D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
难度: 简单查看答案及解析
-
Mg(OH)2在下列四种情况下,其溶解度最大的是
A.在纯水中
B.在0.1 mol·L-1的CH3COOH溶液中
C.在0.1 mol·L-1的NH3·H2O溶液中
D.在0.1 mol·L-1的MgCl2溶液中
难度: 简单查看答案及解析
-
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集Cl2:Cl2+H2O
H++Cl-+HClO
B.热的纯碱溶液碱性增强:CO32-+2H2O
H2CO3+2OH-
C.向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+=2 Fe(OH)3(s)+3Mg2+
D.配制FeCl3溶液时为防止溶液浑浊加入少量稀盐酸Fe3++3H2O
Fe(OH)3+3H+
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A.化学反应速率
B.KNO3的溶解度S
C.化学平衡常数K D.水的离子积常数KW
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,16gCH4含有10NA个电子
B.标准状况下,22.4L苯含有NA个苯分子
C.标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA
D.0.1mol.L-1CH3COOH溶液中含有0.1NA个CH3COO-
难度: 中等查看答案及解析
-
25℃时,水中存在电离平衡:H2O
H++OH- △H>0。下列叙述正确的是
A.将水加热,KW增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
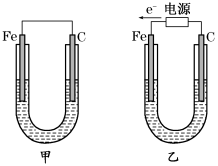
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是

A.产生气体体积:①=②
B.溶液的pH变化:①减小,②增大
C.电极反应式:①中阳极为4OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑
D.①中阴极质量增加,②中正极质量减小
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
难度: 中等查看答案及解析
-
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14。如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-==CuCl。下列说法不正确的是

A.B极发生的电极反应为2H++2e- ==H2↑
B.实验开始时,A极附近出现白色浑浊
C.电解时,Na+移向A极
D.一段时间后,U形管底部形成橙黄色沉淀
难度: 中等查看答案及解析
-
下列各环境下的离子组合一定能大量共存的是
A.c(HCO3-)=1×10-1mol/L的溶液中Na+、Al3+、CH3COO-、K+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+
C.甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+
D.能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42-
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
已知常温下反应①NH3+H+
NH
(平衡常数为K1),②Ag++Cl-
AgCl(平衡常数为K2),③Ag++2NH3
Ag(NH3)
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
难度: 中等查看答案及解析
-
二甲醚是一种绿色、可再生的新能源。下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法错误的是
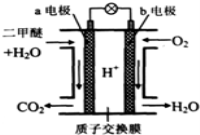
A.a电极为该电池负极
B.O2在b电极上得电子,被氧化
C.电池工作时,a电极反应式: CH3OCH3—12e-+3H2O=2CO2↑+12H+
D.电池工作时,燃料电池内部H+从a电极移向b电极
难度: 中等查看答案及解析
-
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+)+c(M+)=c(OH-)+c(A-)
难度: 困难查看答案及解析
-
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L0.2mol·L-1HF溶液中加入1 L0.2 mol·L-1CaCl2溶液,下列说法中正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C.加入CaCl2溶液后体系中的c(H+)浓度不变
D.该体系中有CaF2沉淀产生
难度: 中等查看答案及解析