-
(实验班)(15分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)  Sr2+(aq)+SO
Sr2+(aq)+SO (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为_________ ________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
-
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将 和
和 转化成难溶弱酸盐。
转化成难溶弱酸盐。
已知:







(1)将SrSO4转化成SrCO3的离子方程式为:_______________________________________,该反应的平衡常数表达式为_____________________________________;该反应能发生的原因是:________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将__________________________________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrSO4。实验所用的试剂为________;实验现象及其相应结论为______________________。
-
(Ⅰ)硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ・mol—1
②BaS(s)=Ba(s)+S(s)△H=+460k J・mol—1
J・mol—1
已知:③2C(s)+O2(g)=2CO(g)△H=-221kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(Ⅱ)污染与环境保护已经成为现在我国最热门 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图

则:
① △H3 0(填“>”、“=”或“<”)。
② 在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
-
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1=+3 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1=+3 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的NaH2PO4,pH应控制在 ; pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (写离子方程式)。
(4)磷的化合物三氯氧磷(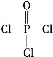 )与季戊四醇(
)与季戊四醇(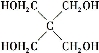 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。

①酸性气体是 (填化学式)
②X的结构简式为 。
-
(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
-
钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:
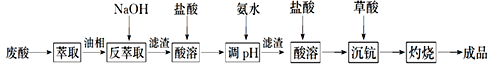
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中 =__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
(4)草酸钪“灼烧”氧化的化学方程式为_____________________________。
(5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。
-
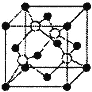
钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为__,阳离子周围最近且等距离得阴离子的个数为__。

(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如右图所示,则A的化学式是__,A中铜元素的化合价为__。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过___键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是__。与NH3分子互为等电子体的一种阳离子是__。
-
磷单质及其化合物在工业生产巾有着广泛的应用。向磷可用于制备高纯度的磷酸(磷酸结构简式为 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 (填元素符号)。
(2)氧原子核外有 种不同能量的电子。
(3)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
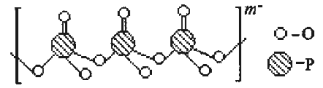
①磷原子的杂化类型为 ;②这种多聚磷酸钠的化学式为
(4) 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性
①NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”“中性”或“弱碱性”)
②次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应生成Ni和H2PO3-,写出上述反应离子方程式
-
N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____O(填“ ”或“
”或“ ”,下同),电负性:S____Cl。
”,下同),电负性:S____Cl。
(2) 的沸点比
的沸点比 高的原因是___________;
高的原因是___________; 属于________(填“极性”或“非极性”)分子,
属于________(填“极性”或“非极性”)分子,
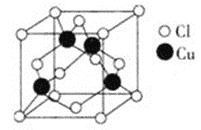
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________。
-
胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
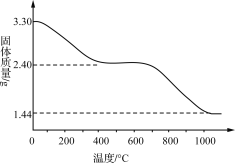
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
Sr2+(aq)+SO
(aq) Ksp=2.5×10-7
Sr2+(aq)+CO
(aq) Ksp=2.5×10-9
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度,平衡常数K将________。


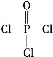 )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。






