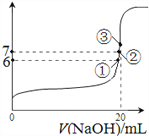
-
把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A. c(CH3COO﹣)<c(Na+)
B. c(CH3COOH)>c(CH3COO-)
C. 2c(H+)=c(CH3COO﹣)﹣c(CH3COOH)
D. c(CH3COOH)+c(CH3COO﹣)=0.01mol/L
难度: 困难查看答案及解析
-
一定条件下,Na2CO3溶液中存在如下平衡:CO32-+H2O
HCO3-+OH-,下列说法正确的是
A. 稀释溶液,平衡正向移动,
增大
B. 通入CO2,平衡逆向移动,溶液pH减小
C. 加入NaOH固体,平衡逆向移动,pH减小
D. 升高温度,
增大
难度: 困难查看答案及解析
-
常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是
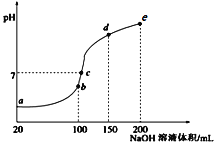
A. b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-)
难度: 简单查看答案及解析
-
25℃时,下列溶液中各离子的浓度关系不正确的是
A. 将0.2 mol·L-1盐酸与0.2 mol·L-1K2CO3溶液等体积混合:c(K+) >c(Cl-) >c(HCO3-) >c(OH-) >c(H+)
B. 25℃时,pH=10、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-)
C. 0.3 mol·L-1HY溶液与0.3 mol·L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1
D. 用0.1 mol·L-1HCl溶液滴定10.0 mL浓度为0.1 mol·L-1Na2CO3溶液,当混合液呈中性时,c(Na+)> c(Cl-) > c(H+)= c(OH-)
难度: 困难查看答案及解析
-
化学上常用AG表示溶液中的lg
。25℃时,用0.100 mol•L-1的NaOH溶液滴定20.00 mL 0.100 mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
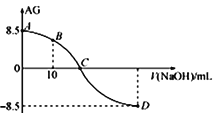
A. 滴定过程中,应选用甲基橙做指示剂
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-4.5
难度: 困难查看答案及解析
-
下列说法正确的是
A. 以下生活常见物质的pH由小到大的顺序为:洁厕灵<白糖水<厨房清洁剂
B. 泡沫灭火器内的成分是苏打溶液和硫酸铝溶液
C. 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到Fe2O3
D. 将光亮Mg条放入盛有氯化铵溶液的试管中,产生的气体只有H2
难度: 困难查看答案及解析
-
下列离子组一定能大量共存的是
A. 酚酞呈红色的溶液中:HCO3-、Cl-、NO3-、Na+
B. 石蕊呈蓝色的溶液中:Na+、Al3+、NO3-、Br-
C. 由水电离出来的C(H+)=10-13mol/L的溶液中:K+、Na+、NO3-、SiO32-
D. 含大量OH一的溶液中:CO32-、Cl-、F-、K+
难度: 中等查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 将1mol SO2通入水中,H2SO3、HSO3-、SO32-粒子数之和为NA
B. 标准状况下,22.4L HF溶于水,溶液中HF与F-数目之和为1NA
C. 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 25℃时,pH=13的Ba(OH)2溶液中含有的氢氧根离子数为0.1NA
难度: 困难查看答案及解析
-
将下列四种溶液适当升高到一定温度后,pH不发生变化的是
A. pH=1的H2SO4溶液 B. NaCl溶液
C. pH=3的NH4Cl溶液 D. pH=13的NaOH溶液
难度: 简单查看答案及解析
-
为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可采取的措施是( )
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s) ⑤加水 ⑥适量Cl2溶液⑦加热
A. ②③④ B. ①②⑤⑥⑦
C. ②③ D. ③④
难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡CH3COOH
H++CH3COO-,下列叙述错误的是
A. 向溶液中加少量的CH3COONa固体,平衡逆向移动,c(CH3COO-)增大
B. 0.10mol/L的CH3COOH溶液中加少量水,平衡正向移动,导电性增强
C. 通入少量NH3气体,c(H+)减小、c(OH-)增加
D. 25℃时,加入少量浓醋酸,平衡正向移动,醋酸的电离程度减弱
难度: 简单查看答案及解析
-
常温下,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,则下列叙述正确的是
A. 加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
B. 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C. 该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
D. 该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
难度: 困难查看答案及解析
-
下列实验操作或对实验事实的叙述正确的是
A. 用干燥的pH试纸测定次氯酸钠溶液的pH值
B. 将Na2SO3、FeCl3、Mg(HCO3)2溶液直接蒸干均不能得到原溶质
C. 用碱式滴定管量取 20.00 mL 0.1 mol·L-1 KMnO4溶液
D. 明矾可用于自来水的净化和杀菌消毒
难度: 中等查看答案及解析
-
已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A. NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B. 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C. 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D. 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
难度: 困难查看答案及解析
-
25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
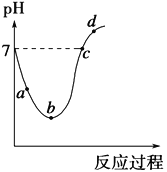
A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
难度: 困难查看答案及解析