-
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡 常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)将浓度为0.1mol·L-1HF溶液加水稀释一倍(假设温度不变),下列各量增大的是___。
A.c(H+) B.c(H+)·c(OH-) C. D.
D.
(2)25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是___。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7mol·L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L-1
(3)物质的量浓度均为0.1mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。依据数据判断pH由大到小的是___。
(4)Na2CO3溶液显碱性是因为 水解的缘故,请设计简单的实验事实证之___。
水解的缘故,请设计简单的实验事实证之___。
(5)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1molHF转移___mol电子。
-
根据电离常数(用Kb表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)氢氟酸的电离方程式为________________________。
(2)同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是_____(写化学式)。
(3)同浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。(填字母)
A.c(H+) B.c(H+)·c(OH—) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(4)25℃时,现有物质的量浓度均为0.1mol/L的四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。(用序号表示)
-
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C. D.
D.
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
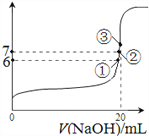
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。
-
根据电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO | H2SO3 |
| 电离平衡常数(Ka) | Ka=7.2×10-4 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ka1=1.0×10-2 Ka2=5.0×10-8 |
(1)25℃时,同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是____________(写化学式)。
(2)将0.1mol·L-1的HF溶液1mL加水稀释至10mL(假设温度不变),下列各量增大的是___________(填写字母)。
A.c(H+) B.c(H+)·c(OH-) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(3)25℃时,现有物质的量浓度均为0.1mol·L-1的下列四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。
依据数据判断其pH由大到小的顺序是_________________________(填写序号)。
(4)根据H2SO3的电离平衡常数,计算25℃时,0.05mol·L-1Na2SO3溶液的pH=__________。
若某Na2SO3和NaHSO3的混合液呈中性,则溶液中c(SO32-)__________ c(HSO3-)(填“大于”、“小于“或“等于")。
-
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
| 化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
| 电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
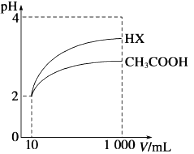
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。
(5)向 0.l mol•L-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。
-
已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 |
常温下,物质的量浓度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其pH由大到小的顺序是___(填序号)。
-
一般情况下,前者无法决定后者的是
A. 原子核外电子排布——元素在周期表中的位置
B. 弱电解质的相对强弱——电离常数的大小
C. 分子间作用力的大小——分子稳定性的高低
D. 物质内部储存的能量——化学反应的热效应
-
25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
-
25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
-
25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
D.






