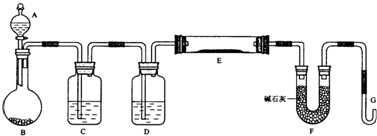
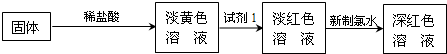
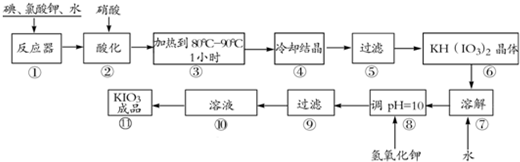
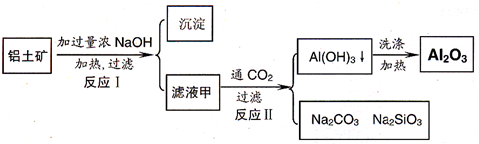
-
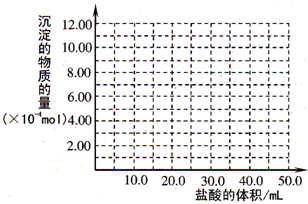
在pH=13的无色溶液中,可以大量共存的一组离子是( )
A.NH4+、NO3-、K+、SO42-
B.CO32_、NO3-、HCO3-、Na+
C.Na+、ClO-、AlO2-、NO3-
D.CrO42-、K+、Na+、SO42-难度: 中等查看答案及解析
-
等量镁铝合金分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2mol•L-1H2SO4溶液
B.18mol•L-1H2SO4溶液
C.6mol•L-1KOH溶液
D.3mol•L-1HNO3溶液难度: 中等查看答案及解析
-
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离【解析】
SO2(l)+SO2(l)⇌SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
A.该滴定反应可以表示为:SO32-+SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点难度: 中等查看答案及解析
-
1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献.他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化.下列说法正确的是( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化难度: 中等查看答案及解析
-
某同学尝试用所学的化学知识解释或解决生活中出现的现象和问题,下列解释或方案中合理的是( )
①利用强弱电解质的导电实验可鉴别纯净水和矿泉水
②打开汽水瓶盖时有大量气泡涌出,可用列夏特勒原理解释
③铁制自来水管与铜制水龙头连接时铁水管锈蚀更快,是因为形成原电池的缘故
④禽流感是一种传染病,高温蒸煮能够杀灭禽流感病毒.
A.①③
B.③④
C.①②
D.全部难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA
B.通常状况下,将0.5mol HI气体和0.5mol氯气混合后气体的分子数为NA
C.18g2H218O所含的中子数为1.8NA
D.53g碳酸钠固体所含离子数为1.5NA难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.非金属单质只能形成分子晶体
D.短周期元素离子和
具有相同的电子层结构,若a>b,则n>m
难度: 中等查看答案及解析
-
已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( )
A.实验③说明KI被氧化
B.实验②中氧化剂与还原剂的物质的量之比为2:1
C.实验①证明Cl-具有还原性
D.上述实验证明氧化性:ClO3-<Cl2<I2难度: 中等查看答案及解析
-
甲、乙两种物质的溶解度曲线如下图所示,下列说法一定正确的是( )
A.A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B.B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等
C.将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的乙比析出的甲多
D.若乙中含有少量的甲,可用重结晶的方法提纯乙难度: 中等查看答案及解析
-
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由温度不同而引起的是( )
①Na+O2 ②P+Cl2 ③C2H5OH+H2SO4 (浓) ④Cu+HNO3 ⑤CO2+NaOH ⑥C2H2+HCl ⑦Fe+H2SO4 ⑧Cl2+NaOH.
A.①③⑧
B.②⑤⑦
C.③④⑧
D.②③⑥难度: 中等查看答案及解析
-
为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
A.将CH3COONa•3H2O晶体溶于水,温度降低
B.醋酸钠水溶液的PH值大于7
C.醋酸钠溶液滴入酚酞是红色,加热后颜色变深
D.醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是( )
A.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
B.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32-+H2O=2NaHCO3↓
D.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O难度: 中等查看答案及解析
-
某温度下,在一容积可变的恒压密闭容器里,反应3A(g)⇌B(g)+3C(g)达到平衡时,A、B和C的物质的量分别为6mol、2mol、6mol.在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入1 mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.将A、B、C各减少1 mol,C的百分含量增加
D.加入一定量的A气体达平衡后,C的百分含量一定增加难度: 中等查看答案及解析
-
室温下,下列混合溶液中,各离子浓度的关系正确的是( )
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1mol/L的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.浓度为0.1mol/L的碳酸钠溶液c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.浓度为0.1mol/L的醋酸钠溶液c(Na+)=c(CH3COO-)>c(OH-)=c(H+)难度: 中等查看答案及解析
-
下列关于氧化物的各项叙述正确的是( )
①酸性氧化物肯定是非金属氧化物; ②非金属氧化物肯定是酸性氧化物; ③碱性氧化物肯定是金属氧化物;
④金属氧化物都是碱性氧化物; ⑤酸性氧化物均可与水反应生成相应的酸;
⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物;
⑦不能跟酸反应的氧化物一定能跟碱反应.
A.①②③④
B.⑤⑥⑦
C.②③⑥⑦
D.③⑥难度: 中等查看答案及解析
-
下列有关比较中,大小顺序排列错误的是( )
A.物质的熔点:石英>食盐>冰>汞
B.热稳定性:PH3>H2S>HBr>NH3
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.结合质子(H+)的能力:CH3COO->CO32->SO42-难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是( )
A.除去溴苯中的少量溴:加入KI溶液,充分反应后,弃去水溶液
B.除去FeCl2溶液中的少量FeCl3:加入足量的铁屑,充分反应后,过滤
C.除去苯酚溶液中的少量甲苯:加入酸性高锰酸钾溶液,充分反应后,弃去水溶液
D.除去N2中的少量O2:将气体通过灼热的氧化铜粉末,再收集气体难度: 中等查看答案及解析
-
在一定条件下利用电解的方法可以将含有少量的Fe、Zn、Cu、Pt等金属杂质的粗镍提纯.下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
A.纯镍作阴极
B.阳极发生还原反应
C.粗镍连接电源的正极,其电极反应为:Ni2++2e-═Ni
D.电解后,电解槽底部有含有Cu和Pt等金属杂质的阳极泥难度: 中等查看答案及解析