-
(14分)铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
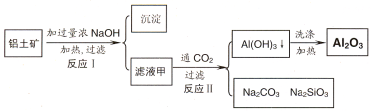
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
A.AlO2― B.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
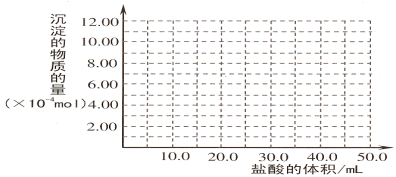
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为:
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
-
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的流程如下:
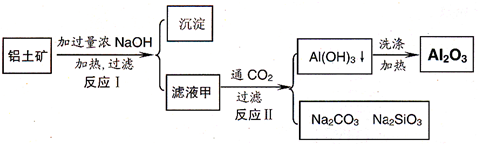
(1)滤液甲的主要成分是______
(2)写出反应 II 的离子方程式:______
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是______(填字母序号)
a.AlO2-或Al(OH)4- b.OH- C.SiO32-
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失.写出阴极的电极反应方程式______,沉淀部分消失的原因可用离子方程式表示为:______
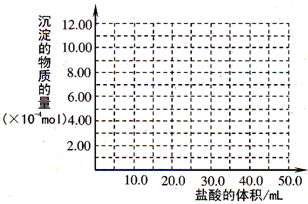
(5)取(4)电解以后的溶液 10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100mol•L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解.请画出生成沉淀的物质的量与加入盐酸体积的关系图.
-
(11 分 )铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
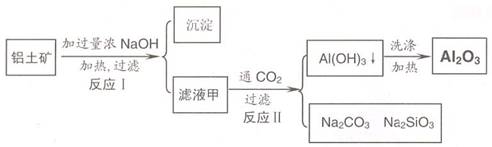
(1)滤液甲的主要成分是________
(2)写出反应 II 的离子方程式:________
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是________(填字母序号)
a.AlO2― 或 Al(OH)4- b.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。写出阴极的电极反应方程式,沉淀消失的原因可用离子方程式表示为:________
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
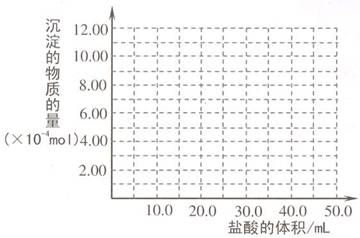
-
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的流程如下:
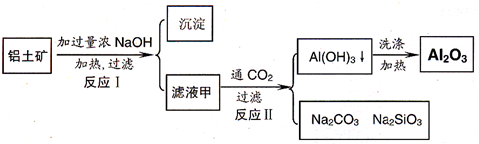
(1)滤液甲的主要成分是______
(2)写出反应 II 的离子方程式:______
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是______(填字母序号)
a.AlO2-或Al(OH)4- b.OH- C.SiO32-
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失.写出阴极的电极反应方程式______,沉淀部分消失的原因可用离子方程式表示为:______
(5)取(4)电解以后的溶液 10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100mol•L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解.请画出生成沉淀的物质的量与加入盐酸体积的关系图.
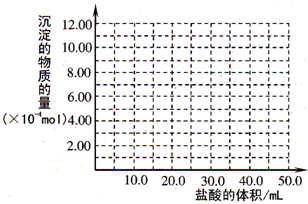
-
铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:

下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
-
工业炼铝是用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的主要原料氧化铝,然后进行电解。工艺流程如下图:
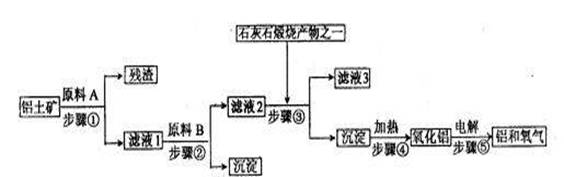
(1)滤液1中要加入稍过量的原料B,原料B的化学式是 。写出步骤②有关反应的离子方、。
(2)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响? 。
(3)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中 极的材料随反应的进行需要不断补充,为什么?
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应 ,而且该反应焊接速度快、设备简易,适于野外作业。
-
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
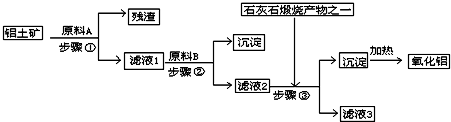
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的离子方程式是:______.
(3)步骤③的化学方程式是:______.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响______.
-
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
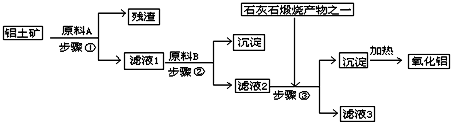
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的离子方程式是:______.
(3)步骤③的化学方程式是:______.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响______.
-
工业上用铝土矿(主要成分是A123,还有少量的Fe23,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
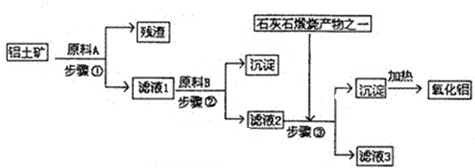
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH) 3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______.
-
铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程
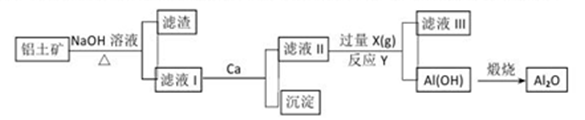
下列说法中错误的是
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质













