-
化学与社会、生活密切相关。对下列现象或事实及解释均正确的是
选项
现象或事实
解释
A
化石燃料燃烧时采取脱硫措施
提高化石燃料的利用率
B
食品袋中常放有硅胶和铁粉,都能起到干燥的作用
二者都有较强的吸水性
C
高温加热能杀死流感病毒
蛋白质受热变性
D
高铁车厢采用铝合金材料
铝和氧气不反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,11.2 L CH3CH2OH 中含有的分子数目为0.5NA
B. 由Na2O2和Na2O组成的混合物共l mol,其中阴离子数为NA
C. 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
D. 1 mol Fe溶于过量硝酸,电子转移数为2NA
难度: 简单查看答案及解析
-
四种短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示,其中Z原子的最外层电子数与其电子层数相同,由此推知下列选项正确的是( )
X
Y
Z
W
A. 工业上在一定条件下电解Z、Y形成的化合物制取Z的单质
B. X、Y、Z的简单离子的半径大小关系为Z>X>Y
C. X、Y、W的简单气态氢化物的稳定性强弱关系为W>X>Y
D. W的氧化物为酸性氧化物,不能与任何酸反应
难度: 中等查看答案及解析
-
下列各组离子中,在给定条件下能够大量共存的是
A. 通入足量SO2气体后的溶液中:H+、Ca2+、Fe3+、NO3-
B. 无色溶液中:Al3+、NH4+、Cl-、S2-
C. 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
D. c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
难度: 简单查看答案及解析
-
下列装置或操作正确且能达到实验目的的是
A.
转移溶液 B.
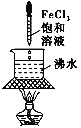 制备Fe(OH)3胶体 C.
制备Fe(OH)3胶体 C. 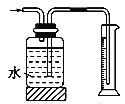 测量氨气的体积 D.
测量氨气的体积 D. 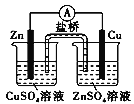 构成铜锌原电池
构成铜锌原电池难度: 中等查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
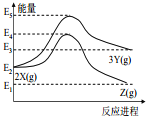
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 将pH=4的弱酸加水稀释10倍,测得其pH<5
B. 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
C. pH=4的CH3COOH溶液和pH=4的NH4Cl溶液,由水电离出的c(OH-)相同
D. 一定温度下,pH=6.5的纯水显中性
难度: 中等查看答案及解析