-
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
第一次
第二次
第三次
第四次
初始读数(mL)
0.40
0.10
0.90
0.00
最终读数(mL)
25.05
20.10
21.00
19.90
V标(mL)
24.65
20.00
20.10
19.90
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________ ②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
高二化学实验题困难题查看答案及解析
-
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
第一次
第二次
第三次
第四次
初始读数(mL)
0.40
0.10
0.90
0.00
最终读数(mL)
25.05
20.10
21.00
19.90
V标(mL)
24.65
20.00
20.10
19.90
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
高二化学实验题中等难度题查看答案及解析
-
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→
②→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
第一次
第二次
第三次
第四次
初始读数(mL)
0.40
0.10
0.90
0.00
最终读数(mL)
25.05
20.10
21.00
19.90
V标(mL)
24.65
20.00
20.10
19.90
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①_________________________; ②_________________________;
(2)KMnO4(H+)溶液应装入______式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_________________________________________,判断已达滴定终点的现象是:_____________________________________________________;
(4)该滴定反应的离子方程式为:________________________________________________;
(5)实验测得草酸溶液的浓度为_____________________________mol/L;
(6)下列操作会引起实验结果偏高的是____________________________。
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
高二化学实验题中等难度题查看答案及解析
-
为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10mol•L-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
高二化学实验题中等难度题查看答案及解析
-
为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10mol•L-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
高二化学实验题中等难度题查看答案及解析
-
某学生用0.1000mol/L KMnO4标准液滴定未知浓度的H2C2O4溶液。(将20.00mL H2C2O4待测液注入锥形瓶,用KMnO4溶液滴定)
回答下列问题:
(1)请写出该实验所需使用的玻璃仪器_________________________。
(2)请简述如何对滴定管进行润洗________________________。
(3)高锰酸钾溶液应使用______式(填“酸”或“碱”) 滴定管盛放。
(4)①在滴定过程是否需要指示剂?_________(填“是”或“否”)
②请描述滴定终点时溶液颜色的变化_________________________。
③若滴定终点时,仰视标准液滴定管的刻线读数,其他操作正确,则测定结果__________(填“偏高”、“偏低”或“无影响”);若最终消耗标准液体积为18.00mL(平均值),则H2C2O4的浓度为_________(结果保留4位有效数字)。
高二化学实验题中等难度题查看答案及解析
-
现用0.1000 mol·L−1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4−+5H2C2O4+6H+
2Mn2++10CO2↑+8H2O。填空完成问题:
(1)该滴定实验必需的玻璃仪器有______________。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
E.铁架台 F.滴定管夹 G.白纸 H.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________。
(3)滴定终点的现象为_________________________________________________________。
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为____mL,终点读数为_____mL。

(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数
待测H2C2O4溶液的体积/mL
0.1000 mol/L KMnO4的体积(mL)
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
高二化学实验题困难题查看答案及解析
-
某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10mol/L的HCl溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“O”以上2-3cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1-2 次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入l
滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度.请回答下列问题:
(1)滴定操作的正确顺序是:(填字母)______→C→______→B→______→______→______.
(2)G步操作中在锥形瓶下垫一张白纸的作用是______.
(3)D步操作中液面应调节到______,尖嘴部分应______.
(4)滴定终点读数时,如果仰视液面,读出的数值______,若滴定前平视读数则由此计算得到的NaOH溶液浓度______.(填“偏大”、“偏小”、“无影响”)高二化学解答题中等难度题查看答案及解析
-
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10 mol/L的HCl溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入最后一滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)滴定操作的正确顺序是:(填字母)________ →C→________ →B→________ →________→________。
(2)G步操作中在锥形瓶下垫一张白纸的作用是________。
(3)D步操作中液面应调节到________,尖嘴部分应________。
(4)滴定终点读数时,如果仰视液面,读出的数值________,若滴定前平视读数则由此计算得到的NaOH溶液浓度________(填“偏大”、“偏小”、“无影响”)
(5)下图分别是量筒、滴定管、温度计的一部分,则量筒,滴定管,温度计分别是________,

高二化学选择题中等难度题查看答案及解析
-
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00 mL HCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10 mol/L的HC!溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上20 cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1-2次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入最后一滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。
请回答下列问题:
(1)滴定操作的正确顺序是:(填字母) →C→ →B→ → → 。
(2)G步操作中在锥形瓶下垫一张白纸的作用是 。
(3)D步操作中液面应调节到 ,尖嘴部分应 。
(4)滴定终点读数时,如果仰视液面,读出的数值 ,若滴定前平视读数则由此计算得到的NaOH溶液浓度 (填“偏大”、“偏小”、“无影响”)
(5)如图分别是量筒、滴定管、温度计的一部分,则量筒,滴定管,温度计分别是 (填编号)。
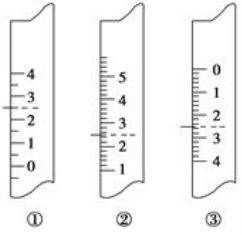
高二化学实验题中等难度题查看答案及解析