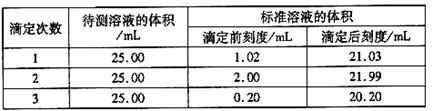
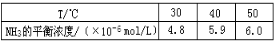-
下列关于化学反应原理的叙述正确的是
A.水能电离出氢离子,故钢铁在潮湿环境中主要发生析氢腐蚀
B.一个反应的焓变不仅与反应起始和最终状态有关,还与反应途径有关
C.合成氨工业选择450℃高温主要是考虑提高化学反应速率,兼顾转化率
D.醋酸溶液越稀,电离程度越大,故电离出的氢离子浓度越大
难度: 中等查看答案及解析
-
下列关于催化剂说法正确的是
A.任何化学反应都需要催化剂
B.催化剂能使不反应的物质之间发生反应
C.催化剂在化学反应前后,化学性质和质量都不变
D.电解水时加少量的NaOH做催化剂,可使电解速率加快
难度: 中等查看答案及解析
-
下列过程属于熵(S)增加的是
A.一定条件下,水由气态变成液态
B.高温高压条件下使石墨转变成金刚石
C.4NO2(g)+O2(g)=2N2O5 (g)
D.CaCO3(s)=CaO(s)+CO2(g)
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+1/2O2(g)=CO(g);ΔH=-110.5kJ·mol-1(燃烧热)
B.2H2O(g)=2H2(g)+O2(g);ΔH=+483.6 kJ·mol-1(反应热)
C.C2H5OH+3O2=2CO2+3H2O;ΔH=-1368.8 kJ·mol-1(反应热)
D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);ΔH=-114.6 kJ·mol-1(中和热)
难度: 中等查看答案及解析
-
反应Fe(s)+CO2(g)
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数
为2.15。下列说法正确的是
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D.该反应的正反应是放热反应
难度: 中等查看答案及解析
-
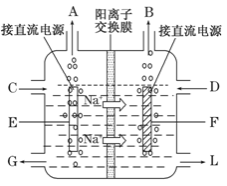
根据下图,下列判断中正确的是
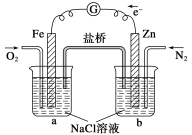
A.烧杯a中的溶液pH升高
B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH-
C.烧杯b中发生还原反应
D.烧杯b中发生的反应为2Cl--2e-=Cl2↑
难度: 中等查看答案及解析
-
25 ℃、101 kPa下:①2Na(s)+O2 (g)===Na2O(s) ;ΔH1=-414 kJ/mol
②2Na(s)+O2 (g)===Na2O2 (s) ;ΔH2=-511 kJ/mol
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2 (s)+2Na(s)===2Na2O(s) ; ΔH=-317 kJ/mol
难度: 中等查看答案及解析
-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
难度: 中等查看答案及解析
-
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡后,若将
平衡体系中各物质的浓度增加一倍,则
A.平衡向逆反应方向移动 B.平衡不移动
C.C的百分含量增大 D.B的浓度减小
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加少量NaHCO3固体后,溶液的漂白性增强
D.在含有[Fe(SCN)3]的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
难度: 中等查看答案及解析
-
下列关于各装置图的叙述中,不正确的是
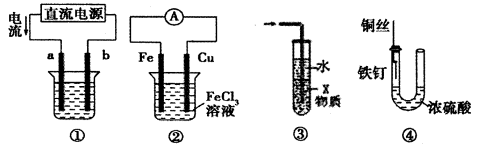
A.装置①中,a为阳极,b为阴极
B.装置②中,发生的总反应为:Cu + 2Fe3+ = 2Fe2+ + Cu2+
C.装置③中,若X为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④中,铁钉几乎不发生腐蚀
难度: 中等查看答案及解析
-
下列有关电解质的电离和水解说法正确的是
A.0.1mol·L-1的氢氟酸溶液加水稀释,平衡正向移动,溶液中各离子浓度均减小
B.pH=2的盐酸酸化的FeCl3溶液,稀释10倍后,溶液pH=3
C.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
D.在25℃时,任何水溶液中KW =1×10-14
难度: 中等查看答案及解析
-
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)
2HI(g)+9.48kJ
②H2(g) + I2(?)
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比②的产物热稳定性更好
D.1 mol固态碘升华时将吸热17 kJ
难度: 中等查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法正确的是
①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-)
A.①⑤ B.③④ C.②⑤ D.②④
难度: 中等查看答案及解析
-
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通过量CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
难度: 中等查看答案及解析
-
已知mX(g)+nY(g)
gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.NaHCO3溶液:K+、Fe3+、SO42-、NO3-
D.Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
难度: 困难查看答案及解析
-
已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如图所示。则其电解过程中溶液pH随时间变化关系的正确图形是下列的
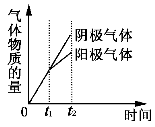
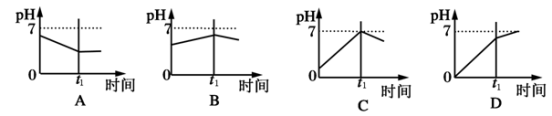
难度: 中等查看答案及解析
-
下列有关化学平衡移动叙述,正确的是
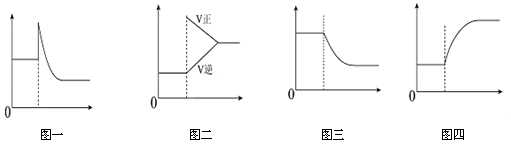
A.可逆反应:Cr2O742-+H2O
2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一
B.可逆反应Co(H2O) 62++ (粉红色)+4Cl-
CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二
C.可逆反应:2NO2
N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三
D.可逆反应:N2(g)+3H2(g)
2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四
难度: 困难查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1 NaHSO3溶液中:c(H+)+c(H2SO3)=c(SO32—)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
难度: 困难查看答案及解析