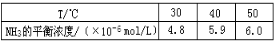-
(14分)Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总= mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
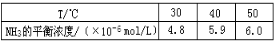
(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。
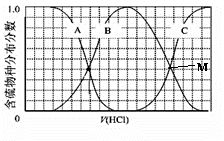
试分析:
①B曲线代表 (用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)= 。
②M点,溶液中主要涉及的离子方程式: 。
-
在一定温度下将1mol CO和9mol水蒸气放在密闭的容器中发生下列反应:
CO(g)+H2O(g)  CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为( )
CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为( )
A.1.2mol B .1.5mol C. 1.8mol D . 2.5mol
-
(1)现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0.在850℃时,K=1.此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
①当x=5.0时,上述反应向________方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”“小于”或“等于”).
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为________.
-
在2 L密闭容器中放入CO(g)、H2O(g)各1 mol,发生CO(g) + H2O(g) = CO2(g) + H2(g)反应(正反应为放热反应),改变下列条件,不能使V正 增大的是
A.升高温度 B.降低温度
C.使用催化剂 D.压缩容器,使其体积变为1 L
-
在2 L密闭容器中放入CO(g)、H2O(g)各1 mol,发生CO(g) + H2O(g) = CO2(g) + H2(g)反应(正反应为放热反应),改变下列条件,不能使V正 增大的是
A.升高温度 B.降低温度
C.使用催化剂 D.压缩容器,使其体积变为1 L
-
向密闭容器中充入1.0 mol CO和2.0 mol H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
A.0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
B.1.0 mol CO+2.0 mol H2O(g)+0.5 mol He
C.1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
-
(7分)(1)现有反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向 方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为________。
-
(10分) (1)在一定条件下,容积为 10 L密闭容器中发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 3 s时有0.1 mol CO生成,则3 s内该反应的平均速率v(H2)=________。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。CO的转化率与温度、压强的关系如图。
CH3OH(g)。CO的转化率与温度、压强的关系如图。

①该反应是反应(填“放热”或“吸热”)。
②150℃时该反应的平衡常数KV2/a2(填“=”“<”或“>”)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,和b mol CH3OH(g),则达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”或“无法确定”),平衡常数________(填“增大”、“减小”或“不变”)。
-
已知:CO(g)+H2O(g) CO2(g)+H2(g)△H=﹣41kJ/mol,相同温度下,在体积相同的三个密闭容器中,加入一定量的物质发生反应,相关数据如下:
CO2(g)+H2(g)△H=﹣41kJ/mol,相同温度下,在体积相同的三个密闭容器中,加入一定量的物质发生反应,相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 |
| CO | H2O | CO2 | H2 | Ar[ |
| ① | 1 | 4 | 0 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 3 | 1 | 1 | 0 | 热量变化:Q1 |
| ③ | 0.5 | 3.5 | 0.5 | 0.5 | 1 | 热量变化:Q2 |
| | | | | | |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.热量数值:Q2 < Q1 =32.8 kJ
C.平衡时,三容器中CO2的浓度相等
D.容器③中反应开始时正反应的浓度商小于该反应平衡常数K
-
已知850℃时,CO(g)+H2O(g) CO2(g)+H2(g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2。
CO2(g)+H2(g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2。
(1)当x=5.0时,判断化学反应进行的方向。
(2)若要使上述反应开始时向正反应方向进行,则x应满足的条件是什么?
(3)若x=5.0,当上述反应达到平衡后,计算H2的体积分数。
CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表: