-
(原创)下列各组物质与其用途的关系正确的是
A.碘化钾——食盐中的加碘物质 B.二氧化硅——太阳能电池
C.福尔马林——食品保鲜剂 D.水玻璃——耐火材料
难度: 简单查看答案及解析
-
用下列装置进行相应实验,能达到实验目的的是

A.图1为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀
B.图2所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.图3所示装置可以用来制备氢氧化亚铁
D.图4所示装置可以用来测定中和热
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中可以大量共存的是
A.pH = 12的溶液:Ca2+、NH4+、Br-、HSO3-
B.无色溶液:K+、Al3+、HCO3-、Cl-
C.通入H2S无沉淀的溶液:Fe2+、Na+、I-、SO42-
D.c(H+) = 1×10-2mol/L的溶液:Fe2+、Br-、ClO-、Cl-
难度: 困难查看答案及解析
-
铵明矾NH4Al(SO4)2·12H2O是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是
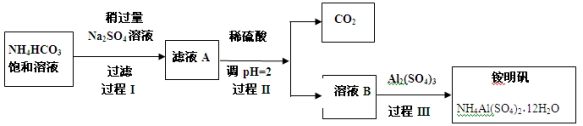
A.过程I反应为:2NH4HCO3 + Na2SO4 = 2NaHCO3 ↓ + (NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程II,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
难度: 困难查看答案及解析
-
(原创)某有机物的结构简式如图所示,关于该有机物的说法不正确的是

A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol
难度: 困难查看答案及解析
-
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是
A.25℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6
B.向溶液中加入少量CH3COONa固体,溶液中
的值变小
C.向溶液中加入10 mL 0.1 mol·L-1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1盐酸,所得溶液中离子的浓度一定符合:c(NH4+) + c(H+) = c(Cl-) + c(OH-)
难度: 困难查看答案及解析
-
恒温恒压下,向密闭容器中充入4 mol A和2 mol B,发生反应:2A(g)+ B(g)
2C(g);△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是
A.若反应开始时容器体积为2 L,则vc=0.4 mol/(L•min)
B.若在恒压绝热条件下反应,平衡后nc<1.6 mol
C.若2min后,向容器中再投入等物质的量A和C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
难度: 困难查看答案及解析

 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)



