-
化学与社会、生活密切相关。下列说法正确的是
A.用钢瓶储存液氯或浓硫酸
B.对石油进行分馏可以得到许多苯的同系物
C.汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的
D.在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.0.1mol
离子含有的电子、中子数均为1.0NA
B.标准状况下,4.48L己烷含有的分子数为0.2NA
C.总质量为5.6g的CaO和CaC2混合物中,所含离子总数小于0.2NA
D.常温常压下,0.1molNH3与0.1molHCl充分反应后所得产物含0.1NA个分子
难度: 中等查看答案及解析
-
A的分子式为C4H10O3,1molA与足量的Na反应会生成1.5molH2,则符合条件的A的结构有(一个C上连多个—OH不稳定,不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 困难查看答案及解析
-
右图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:d>a>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
难度: 中等查看答案及解析
-
一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
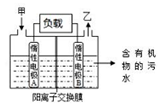
A.B电极为正极
B.气体乙可能为CO2
C.O2在A电极得电子
D.电池工作时,B电极附近的pH逐渐减小
难度: 中等查看答案及解析
-
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是
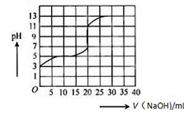
A.该弱酸在滴定前的浓度大于0.001mol/L
B.由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定终点时,c(Na+) >c(A-) > c(OH-) >c(H+)
难度: 中等查看答案及解析
-
下列实验中,对应的现象和结论都正确,且两者具有因果关系的是
选项
实验
现象
结论
A
向某溶液滴加过量的稀盐酸
有刺激性气味气体产生,溶液中出现淡黄色沉淀
溶液中一定存在S2-和SO32-
B
向KI溶液中加热淀粉,然后再加入1.0mol•L-1的H2SO4溶液
开始时无明显现象,加入H2SO4溶液后溶液变蓝
H2SO4能氧化I-
C
将石蜡油(烷烃混合物)蒸汽通过炽热的碎瓷片,再将生成的气体通入溴水中
溴水褪色
石蜡油被催化裂解,生成了不饱和烃
D
分别向等浓度的Na2CO3与NaHCO3溶液中加入等量的盐酸
NaHCO3溶液中产生气泡的速率更快
CO32-结合H+能力比HCO3-弱
难度: 中等查看答案及解析
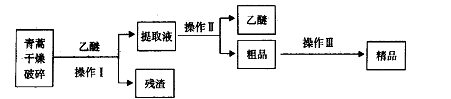
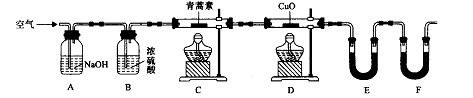
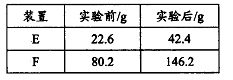
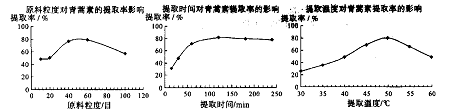
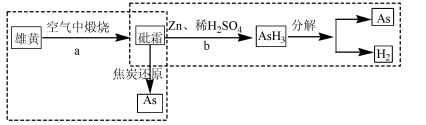
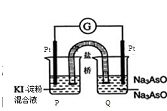
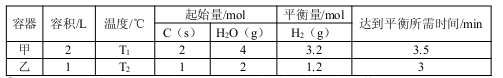
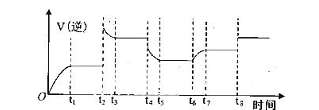

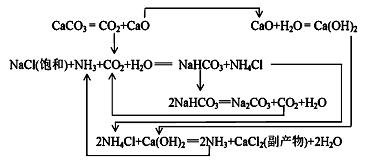
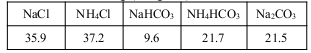
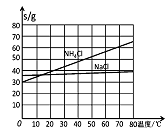

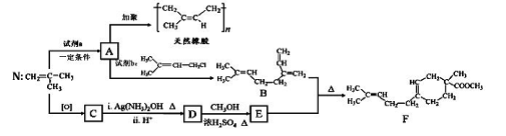
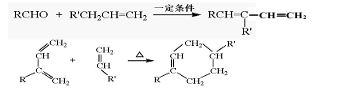
 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。