-
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:
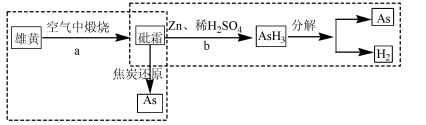
反应a产生的废气直接排放可能带来的环境问题是__________ _____,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
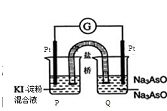
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
-
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为 。NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-) C(AsO33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式: 。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3。写出上述鉴定过程中有关反应的化学方式: 。
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为 。
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为 。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为 (填“P”或“Q”)。
-
(13分) X、Y、Z、R为短周期元素,原子序数依次增大。X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等。
(1)R位于元素周期表第_①_____周期,第_②______族。
(2)X、R元素的最高价氧化物对应的水化物中,酸性较强的是_______。(填化学式)
(3)Y元素所在周期中,电负性最大的元素是_______。
(4)X和R形成的物质是一种超硬材料,其晶胞结构如图所示,晶胞中X原子的个数是________。
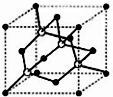
(5)X的单质完全燃烧生成的产物分子中,σ键与π键的数目之比是_______。
(6)Y和Z所形成的化合物ZY难溶于水,但易发生水解。ZY在NaOH溶液中水解的离子方程式是__________________________________________。
-
A、B、C、D、E、F、G 为短周期主族元素,其原子半径与最外层电子数的关系如图,下列说法正确的是
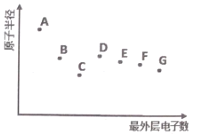
A.根据元素B 在元素周期表中的位置推测,其最高价氧化物对应的水化物可能具有两性
B.元素D在自然界中主要以游离态存在,其单质可用作半导体材料
C.元素A的离子半径大于元素G的离子半径
D.元素F 的气态氢化物比元素G的气态氢化物更稳定
-
七种短周期主族元素①~⑦,其原子序数依次增大,②元素是地壳中含量最多的,⑤元素为两性元素,④⑦两元素组成的化合物是我们日常生活必须的调味品,②和⑥元素的原子序数之和是①和④两元素原子序数之和的两倍。请用化学用语回答下列问题:
(1)③、⑤、⑥的简单离子半径由大到小的顺序为_______________________。
(2)⑥和⑦的最高价氧化物对应的水化物的酸性强弱为___________>___________。
(3)写出二氧化硅与含上述某种元素的酸反应的化学方程式_________________。
(4)由⑤和空气、海水构成的原电池中,其正极反应式为_____________________。
(5)由上述元素形成的物质可发生下图中的反应,其中B、C、G 是单质,B为黄绿色气体。

①写出D溶液与G反应的化学方程式________________________________。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,写出能解释它在苛性钠溶液中发生反应的原因的电离方程式_________________________________。
③写出电解A溶液的离子方程式_______________________________。
-
W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,w、X、Z的简单离子具有相同的电子层结构,W的单质是空气中含量最多的气体,X的氧化物具有两性,Y的最高正价与最低负价的代数和为O,下列说法正确的是
A.单质熔点:w>Z B.离子半径:w>x>Z
C.最高正价:w>X>Z D.原子序数:Z>w>Y
-
某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
-
某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
-
某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,下列说法错误的是( )
A.该元素最高价氧化物既能与酸反应,又能与碱反应,故称该氧化物为两性氧化物
B.该元素在自然界中只以化合态存在
C.该元素单质常用作半导体材料
D.甲烷比该元素的气态氢化物稳定

AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。




