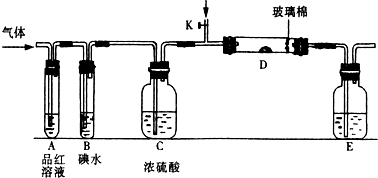
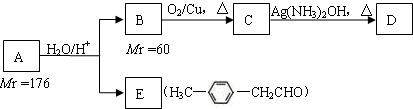
-
化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1mol H2O2含有极性共价键为NA,含有非极性键为2NA
B.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
C.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列做法中不正确的是( )
A.回收废旧电池,主要目的是回收其中的金属
B.减少燃煤的使用,改用风能、太阳能等能源,符合“低碳生活”理念
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可以实现水果保鲜的目的难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.浓烧碱溶液中加入铝片:A1+2OH-=A1O2-+H2↑
B.以石墨作电极电解氯化铝溶液:2C1-+2H2O2OH-+H2↑+C12↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O难度: 中等查看答案及解析
-
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( )
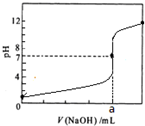
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定
D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00难度: 中等查看答案及解析
-
向体积为2L的密闭容器中充入2mol SO2和1mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2mol SO3,则下列说法正确的是( )
A.充入2mol SO3后,SO2的物质的量不变
B.第一次反应达到平衡时共放出热量176.4 kJ
C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同难度: 中等查看答案及解析
-
下列实验对应的结论不正确的是( )
A.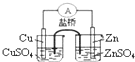
能组成Zn、Cu原电池
B.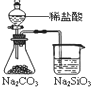
能证明非金属性Cl>C>Si
C.
说明反应2NO2⇌N2O4,△H<0
D.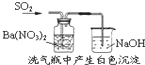
白色沉淀为BaSO4难度: 中等查看答案及解析
-
有一定量的Na、Al合金置于水中,结果合金完全溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀量最大时,消耗40mL的盐酸.原合金中Na的物质的量是( )
A.0.04 mol
B.0.03 mol
C.0.02 mol
D.0.01 mol难度: 中等查看答案及解析
-
用36.5%的浓盐酸配1mol•L-1的稀盐酸 100mL,配制过程需用到哪些仪器,且先后顺序正确的是( )
①100mL量筒 ②10mL量筒 ③50mL 烧杯 ④托盘天平⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
A.①③⑤⑥⑦
B.②⑥③⑦⑤⑥
C.③⑤⑦⑥①
D.④③⑦⑤⑥难度: 中等查看答案及解析
-
常温下,下列各组离子在给定条件下一定能大量共存的是( )
A.在pH=0的溶液中:I-、Ca2+、NO3-、NH4+
B.存在大量Fe2+的溶液:SCN-、Na+、NO3-、SO42-
C.在由水电离出的c(OH-)=10-13mol•L-1的溶液中:ClO-、Na+、SO32-、Cl-
D.在c(OH-)=1.0ⅹ10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32-难度: 中等查看答案及解析
-
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe (NO3)x+NO↑+14H2O.下列判断合理的是( )
A.Fe (NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化难度: 中等查看答案及解析
-
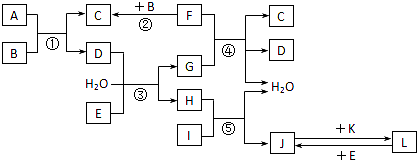
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐.下列说法不正确的是( )
AB
C
D
E
F.
A.当X是强酸时,ABCDEF均含有同一种元素,F是硫酸
B.当X是强碱时,ABCDEF均含有同一种元素,F是硝酸
C.B和Cl2的反应一定是氧化还原反应
D.当X是强酸时,C常温下是气态单质难度: 中等查看答案及解析
-
做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速退去,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++.下列有关叙述正确的是( )
A.发生还原反应的是H2C2O4
B.该离子方程式右侧方框内的产物是OH-
C.1 mol草酸分子中含9mol共用电子对
D.10 mol H+参加反应时,电子转移5mol难度: 中等查看答案及解析
-
下列反应所得溶液中一定只含一种溶质的是( )
A.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
B.向稀硝酸中加入铁粉
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向NaOH溶液中通入CO2气体难度: 中等查看答案及解析
-
K35ClO3晶体与H37Cl的溶液反应后,生成氯气,氯化钾和水.下列说法正确的是( )
A.氯化钾既不是氧化产物,也不是还原产物
B.被还原的K35ClO3和被氧化的H37Cl的物质的量之比为1:6
C.生成氯气的相对分子质量为72
D.每生成标准状况下的氯气11.2L,转移电子数为6.02×1023难度: 中等查看答案及解析