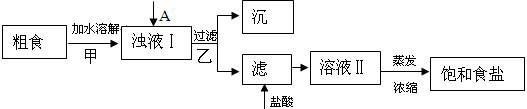
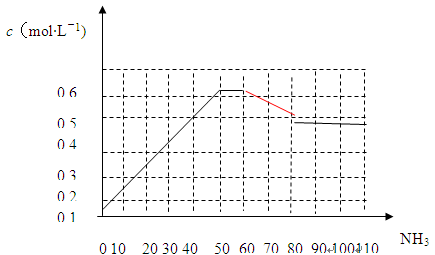
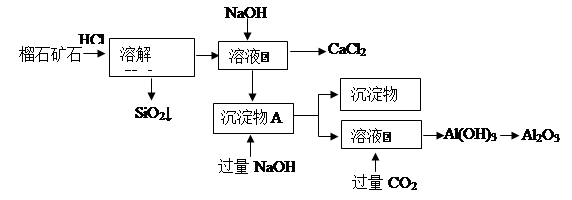
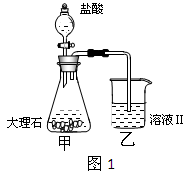
-
2011年是国际化学年,中国的宣传口号是“化学——我们的生活,我们的未来”。下列叙述不正确的是
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因
C.研发高效低毒的农药,降低蔬菜的农药残留量
D.天然药物无任何毒副作用,可长期服用
难度: 简单查看答案及解析
-
37 17Cl、35 17Cl为不同的核素,NA为阿伏加德罗常数,下列说法正确的是
A.常温下,4.48L 35 17Cl2含有0.72NA个中子
B.37 17Cl、35 17Cl互为同位素,35 17Cl2与37 17Cl2互为同分异构体
C.通常情况下,氯气做氧化剂,但氯气也具有还原性
D.37 17Cl2的摩尔质量是74
难度: 简单查看答案及解析
-
将一浅绿色溶液,置于空气中,变黄色。将此黄色溶液逐滴滴入沸水中,形成一种红褐色胶体,下列说法中错误的是
A.该浅绿色溶液中含有Fe2+在空气中被氧化为Fe3+
B.欲检验该黄色溶液中,是否含有未被氧化的Fe2+,向其中滴加KSCN溶液
C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化
D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色
难度: 简单查看答案及解析
-
下列说法正确的是
A.电离是电解质离解成能够自由移动的离子的过程,与是否通电无关
B.有单质参加的反应,均为氧化还原反应
C.阿伏加德罗常数是6.02×1023
D.氢氧化铝是两性氢氧化物,氧化铝是两性氧化物,铝也是两性金属
难度: 简单查看答案及解析
-
下列关于物质的分类说法中,正确的是
A.SO2、NO2是酸性氧化物
B.分散系一定是混合物
C.盐酸能导电,是电解质
D.最外层电子数少于4的元素一定是金属元素
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.S2-的结构示意图:
B.原子核内有10个中子,8个质子的原子:18 8O
C.HSO3-的电离方程式:HSO3-= H++SO32-
D.2gH2在25℃101kPa下燃烧,生成液态的水放出285.8kJ·mol-1的热量,则该反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ·mol-1
难度: 简单查看答案及解析
-
元素的原子结构决定其性质和周期表中的位置,下列有关结构和性质的说法中,正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.元素周期表中,第三周期最右端的元素得电子能力最强
C.最易失去的电子能量最高
D.目前使用的元素周期表中最长的周期含有36种元素
难度: 简单查看答案及解析
-
关于反应3O2(g) = 2O3(g) △H>0,下列说法正确的是
A.反应前后,熵不变
B.反应前后,分子总数不变
C.反应前后,生成物总能量与反应物的总能量不变
D.反应前后,氧元素化合价不变
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.钠与水反应
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
反应SiO2(s)+3C(s)=SiC(s)+2CO(g) △H>0的叙述中,正确的是
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只做还原剂
D.若生成1molSiC转移电子为2mol
难度: 简单查看答案及解析
-
锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为:V2O5+xLi→LixV2O5,下列说法不正确的是
A.向外供电时,锂离子向负极移动
B.负极上反应的物质是锂,正极上反应的物质是V2O5
C.正极的电极反应为:V2O5+xe-+xLi+→LixV2O5
D.负极的电极反应为:xLi-xe-→ xLi+
难度: 简单查看答案及解析
-
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
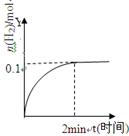
A.该温度下,反应的平衡常数是
B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1
C.恒压下向该体系中加入N2,平衡不移动,反应速率不变
D.升高温度,平衡向正反应方向移动,只有正反应速率加快
难度: 简单查看答案及解析
-
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
A.醋酸的电离程度逐渐增大,溶液的PH值减小
B.Kw逐渐减小
C.水的电离程度增大
D.
变大
难度: 简单查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量
A.①②③ B.①②⑤ C.①②③⑤ D.①③
难度: 简单查看答案及解析
-
下列说法不正确的是
A.凡是铵盐均能与苛性钠共热产生氨气
B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解
C.将二氧化硫通入溴水,溴水退色后加热不能恢复原色
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
难度: 简单查看答案及解析
-
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是
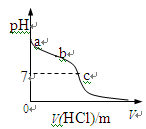
A.a点:pH=14
B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-)
C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1
D.c点后,溶液中离子浓度大小关系一定为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
下列实验不合理的是
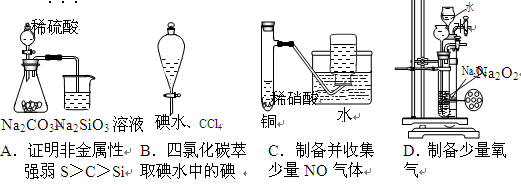
难度: 简单查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq),某I2、KI混合溶液中,c(I3-)
与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
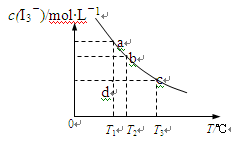
A.反应I2(aq)+I-(aq)
I3-(aq)△H<0
B.状态a与状态b相比,状态b时I2的转化率更高
C.若T1时,反应进行到状态d时,一定有υ正>υ逆
D.温度为T1时,向该平衡体系中加入KI固体,平衡正向移动
难度: 简单查看答案及解析